Eau bouillante
 L’eau est une substance transparente et presque incolore composée des éléments chimiques hydrogène et oxygène , liés par des liaisons covalentes . Sur Terre, l’eau existe à l’état gazeux ( vapeur ou vapeur d’eau ), liquide et solide (glace). C’est l’un des composés les plus abondants et les plus essentiels et c’est le constituant principal des cours d’eau, des lacs et des océans de la Terre, ainsi que des fluides de la plupart des organismes vivants. C’est vital pour toutes les formes de vie connues.
L’eau est une substance transparente et presque incolore composée des éléments chimiques hydrogène et oxygène , liés par des liaisons covalentes . Sur Terre, l’eau existe à l’état gazeux ( vapeur ou vapeur d’eau ), liquide et solide (glace). C’est l’un des composés les plus abondants et les plus essentiels et c’est le constituant principal des cours d’eau, des lacs et des océans de la Terre, ainsi que des fluides de la plupart des organismes vivants. C’est vital pour toutes les formes de vie connues.
En plus d’être essentielle à la vie, l’eau est une substance remarquable avec de nombreuses propriétés surprenantes.
- C’est le seul composé chimique présent naturellement dans les trois états physiques : gazeux (vapeur d’eau ou vapeur d’eau), liquide et solide (glace).
- C’est le seul liquide inorganique présent naturellement sur la Terre.
- L’eau diffère également de la plupart des liquides en ce sens qu’elle devient moins dense à mesure qu’elle gèle . Sa densité maximale est de 3,98 ° C (1 000 kg / m 3 ), alors que celle de la glace est de 917 kg / m 3 . Il diffère d’environ 9% et la glace flotte donc sur l’ eau liquide
- L’eau a la chaleur spécifique la plus élevée de toutes les substances courantes – 4,19 kJ / kg K.
- Il a de très haute chaleur de vaporisation, ce qui en fait un refroidissement efficace et moyenne dans les centrales thermiques et autres industrie de l’ énergie.
Source: wikipedia.org CC BY-SA
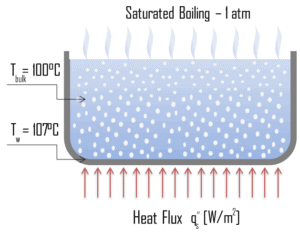
Dans les chapitres précédents, nous avons traité du transfert de chaleur par convection avec une hypothèse très importante. Nous avons supposé un transfert de chaleur par convection monophasé sans changement de phase. Dans ce chapitre, nous nous concentrons sur le transfert de chaleur par convection associé au changement de phase d’un fluide . Nous considérons en particulier les processus qui peuvent se produire à une interface solide-liquide ou solide-vapeur, à savoir l’ ébullition (changement de phase liquide à vapeur) et la condensation ( changement de phase vapeur à liquide).
Dans ces cas, les effets de la chaleur latente associés au changement de phase sont importants. La chaleur latente , également connue sous le nom d’enthalpie de vaporisation, est la quantité de chaleur ajoutée ou retirée d’une substance pour produire un changement de phase. Cette énergie décompose les forces d’attraction intermoléculaires, et doit également fournir l’énergie nécessaire à l’expansion du gaz (le travail pΔV ). Lorsque de la chaleur latente est ajoutée, aucun changement de température ne se produit.
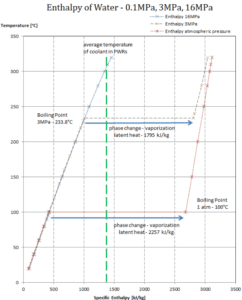
L’ enthalpie de vaporisation est fonction de la pression à laquelle cette transformation a lieu.
Chaleur latente de vaporisation – eau à 0,1 MPa (pression atmosphérique)
h lg = 2257 kJ / kg
Chaleur latente de vaporisation – eau à 3 MPa
h lg = 1795 kJ / kg
Chaleur latente de vaporisation – eau à 16 MPa (pression à l’intérieur d’un pressuriseur )
h lg = 931 kJ / kg
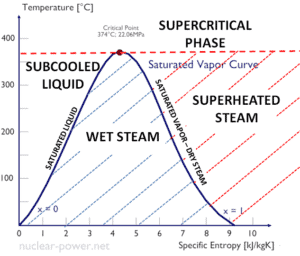
La chaleur de vaporisation diminue avec l’augmentation de la pression, tandis que le point d’ébullition augmente. Elle disparaît complètement à un certain point appelé le point critique . Au-dessus du point critique, les phases liquide et vapeur sont indiscernables et la substance est appelée fluide supercritique .
 Le passage du liquide à l’état de vapeur dû à l’ ébullition est soutenu par le transfert de chaleur de la surface solide; à l’inverse, la condensation d’une vapeur à l’état liquide entraîne un transfert de chaleur vers la surface solide. L’ébullition et la condensation diffèrent des autres formes de convection en ce qu’elles dépendent de la chaleur latente de vaporisation , qui est très élevée pour les pressions courantes , donc de grandes quantités de chaleur peuvent être transférées pendant l’ébullition et la condensation essentiellement à température constante. Les coefficients de transfert de chaleur , h, associés à l’ ébullition et à la condensation sont généralement beaucoup plus élevésque ceux rencontrés dans d’autres formes de processus de convection qui impliquent une seule phase.
Le passage du liquide à l’état de vapeur dû à l’ ébullition est soutenu par le transfert de chaleur de la surface solide; à l’inverse, la condensation d’une vapeur à l’état liquide entraîne un transfert de chaleur vers la surface solide. L’ébullition et la condensation diffèrent des autres formes de convection en ce qu’elles dépendent de la chaleur latente de vaporisation , qui est très élevée pour les pressions courantes , donc de grandes quantités de chaleur peuvent être transférées pendant l’ébullition et la condensation essentiellement à température constante. Les coefficients de transfert de chaleur , h, associés à l’ ébullition et à la condensation sont généralement beaucoup plus élevésque ceux rencontrés dans d’autres formes de processus de convection qui impliquent une seule phase.
Cela est dû au fait que, même en écoulement turbulent , il existe une couche de film fluide stagnant (sous-couche laminaire), qui isole la surface de l’échangeur de chaleur. Cette couche de film fluide stagnant joue un rôle crucial pour le coefficient de transfert de chaleur convectif. On observe que le fluide s’arrête complètement à la surface et prend une vitesse nulle par rapport à la surface. Ce phénomène est connu sous le nom de condition antidérapante et donc, à la surface, le flux d’énergie se produit uniquement par conduction. Mais dans les couches suivantes, il se produit à la fois un mouvement de conduction et de diffusion-masse au niveau moléculaire ou au niveau macroscopique. En raison du mouvement de masse, le taux de transfert d’énergie est plus élevé. Comme il a été écrit,l’ébullition nucléée à la surface perturbe efficacement cette couche stagnante et, par conséquent, l’ébullition nucléée augmente considérablement la capacité d’une surface à transférer de l’énergie thermique au fluide en vrac.
Modes d’ébullition – Types d’ébullition
 D’un point de vue technique pratique, l’ ébullition peut être classée selon plusieurs critères .
D’un point de vue technique pratique, l’ ébullition peut être classée selon plusieurs critères .
Catégorisation par le régime d’écoulement:
- Ébullition de la piscine . La configuration la plus courante, connue sous le nom d’ ébullition de la piscine, est peut-être lorsqu’un bassin de liquide est chauffé par le bas à travers une surface horizontale. En ébullition, le liquide est au repos et son mouvement près de la surface est principalement dû à la convection naturelle et au mélange induit par la croissance et le détachement des bulles. Le travail de pionnier sur l’ébullition de la piscine a été réalisé en 1934 par S. Nukiyama. Il a été le premier à identifier quatre régimes différents bien connus d’ébullition en piscine à l’ aide de son appareil.
 Ébullition d’écoulement. En ébullition (ou ébullition par convection forcée), l’écoulement de fluide est forcé sur une surface par des moyens externes tels qu’une pompe , ainsi que par des effets de flottabilité. Par conséquent, l’ ébullition du flux s’accompagne toujours d’autres effets de convection. Les conditions dépendent fortement de la géométrie, ce qui peut impliquer un écoulement externe sur des plaques et des cylindres chauffés ou un écoulement interne (conduit). Dans les réacteurs nucléaires , la plupart des régimes d’ébullition sont simplement des ébullitions à convection forcée.
Ébullition d’écoulement. En ébullition (ou ébullition par convection forcée), l’écoulement de fluide est forcé sur une surface par des moyens externes tels qu’une pompe , ainsi que par des effets de flottabilité. Par conséquent, l’ ébullition du flux s’accompagne toujours d’autres effets de convection. Les conditions dépendent fortement de la géométrie, ce qui peut impliquer un écoulement externe sur des plaques et des cylindres chauffés ou un écoulement interne (conduit). Dans les réacteurs nucléaires , la plupart des régimes d’ébullition sont simplement des ébullitions à convection forcée.
Catégorisation par la température de surchauffe du mur, ΔT sat :
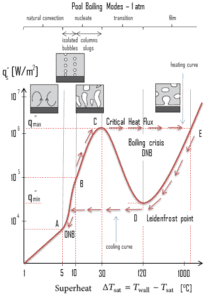 Le travail de pionnier sur l’ébullition a été fait en 1934 par S. Nukiyama , qui a utilisé des fils de nichrome et de platine chauffés électriquement immergés dans des liquides dans ses expériences. Nukiyama a été le premier à identifier différents régimes d’ébullition de la piscine à l’ aide de son appareil. Il a remarqué que l’ébullition prend différentes formes, en fonction de la valeur de la température de surchauffe du mur ΔT sat (connue également sous le nom de surchauffe) , qui est définie comme la différence entre la température du mur, T wall et la température de saturation, T sat .
Le travail de pionnier sur l’ébullition a été fait en 1934 par S. Nukiyama , qui a utilisé des fils de nichrome et de platine chauffés électriquement immergés dans des liquides dans ses expériences. Nukiyama a été le premier à identifier différents régimes d’ébullition de la piscine à l’ aide de son appareil. Il a remarqué que l’ébullition prend différentes formes, en fonction de la valeur de la température de surchauffe du mur ΔT sat (connue également sous le nom de surchauffe) , qui est définie comme la différence entre la température du mur, T wall et la température de saturation, T sat .
Quatre régimes d’ébullition différents de l’ébullition en piscine (basés sur la température excessive) sont observés:
- Ebullition par convection naturelle ΔT sat <5 ° C
- Nucleate Ebullition 5 ° C < ΔT sat <30 ° C
- Ébullition de transition 30 ° C < ΔT sat <200 ° C
- Film bouillant 200 ° C < ΔT sat
Description des modes d’ébullition :
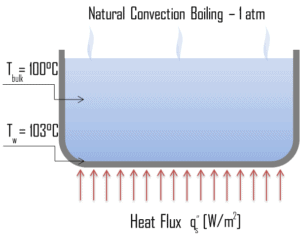 Ébullition par convection naturelle. En thermodynamique , l’exigence d’ ébullition des substances pures est que T wall = T sat . Mais dans les expériences réelles, l’ébullition ne se produit que lorsque le liquide est chauffé à quelques degrés au-dessus de la température de saturation. La température de surface doit être légèrement supérieure à la température de saturation afin de maintenir la formation de vapeur. Dans ce mode d’ébullition , de la vapeur sera observée à la surface de l’eau, mais généralement pas de bullessera observée. Au fur et à mesure que la température de surchauffe augmente, la création de bulles finira par se produire, mais en dessous du point A, le mouvement du fluide est principalement déterminé par les courants de convection naturels. Le point A est généralement appelé début de l’ébullition nucléée – ONB .
Ébullition par convection naturelle. En thermodynamique , l’exigence d’ ébullition des substances pures est que T wall = T sat . Mais dans les expériences réelles, l’ébullition ne se produit que lorsque le liquide est chauffé à quelques degrés au-dessus de la température de saturation. La température de surface doit être légèrement supérieure à la température de saturation afin de maintenir la formation de vapeur. Dans ce mode d’ébullition , de la vapeur sera observée à la surface de l’eau, mais généralement pas de bullessera observée. Au fur et à mesure que la température de surchauffe augmente, la création de bulles finira par se produire, mais en dessous du point A, le mouvement du fluide est principalement déterminé par les courants de convection naturels. Le point A est généralement appelé début de l’ébullition nucléée – ONB .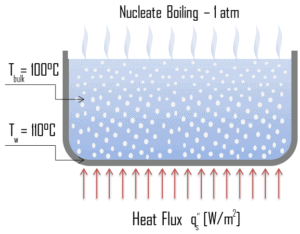 Nucleate Boiling. L’ébullition locale la plus courante rencontrée dans les installations nucléaires est l’ ébullition nucléée . Dans l’ ébullition nucléée , des bulles de vapeur se forment à la surface de transfert de chaleur, puis se détachent et sont transportées dans le courant principal du fluide. Un tel mouvement améliore le transfert de chaleur car la chaleur générée à la surface est directement transportée dans le flux de fluide. Une fois dans le flux de fluide principal, les bulles s’effondrent parce que la température globale du fluide n’est pas aussi élevée que la température de la surface de transfert de chaleur où les bulles ont été créées. Ce processus de transfert de chaleur est parfois souhaitable car l’énergie créée à la surface de transfert de chaleur est rapidement et efficacement «emportée».
Nucleate Boiling. L’ébullition locale la plus courante rencontrée dans les installations nucléaires est l’ ébullition nucléée . Dans l’ ébullition nucléée , des bulles de vapeur se forment à la surface de transfert de chaleur, puis se détachent et sont transportées dans le courant principal du fluide. Un tel mouvement améliore le transfert de chaleur car la chaleur générée à la surface est directement transportée dans le flux de fluide. Une fois dans le flux de fluide principal, les bulles s’effondrent parce que la température globale du fluide n’est pas aussi élevée que la température de la surface de transfert de chaleur où les bulles ont été créées. Ce processus de transfert de chaleur est parfois souhaitable car l’énergie créée à la surface de transfert de chaleur est rapidement et efficacement «emportée».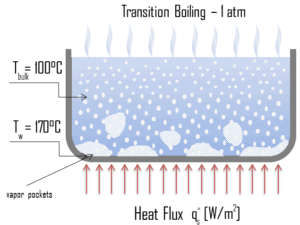 Ébullition de transition. Le flux de chaleur d’ébullition nucléée ne peut pas être augmenté indéfiniment. À une certaine valeur, nous l’appelons le « flux de chaleur critique » ( CHF ), la vapeur produite peut former une couche isolante sur la surface, qui à son tour détériore le coefficient de transfert de chaleur. En effet, une grande partie de la surface est recouverte d’un film de vapeur, qui agit comme une isolation thermique en raison de la faible conductivité thermique de la vapeur par rapport à celle du liquide. Immédiatement après que le flux de chaleur critique a été atteint, l’ ébullition devient instable et l’ ébullition de transition se produit. La transition de l’ébullition nucléée à l’ébullition pelliculaire est connue sous le nom de « crise d’ébullition“. Étant donné qu’au-delà du point CHF, le coefficient de transfert de chaleur diminue, la transition vers l’ébullition du film est généralement inévitable.
Ébullition de transition. Le flux de chaleur d’ébullition nucléée ne peut pas être augmenté indéfiniment. À une certaine valeur, nous l’appelons le « flux de chaleur critique » ( CHF ), la vapeur produite peut former une couche isolante sur la surface, qui à son tour détériore le coefficient de transfert de chaleur. En effet, une grande partie de la surface est recouverte d’un film de vapeur, qui agit comme une isolation thermique en raison de la faible conductivité thermique de la vapeur par rapport à celle du liquide. Immédiatement après que le flux de chaleur critique a été atteint, l’ ébullition devient instable et l’ ébullition de transition se produit. La transition de l’ébullition nucléée à l’ébullition pelliculaire est connue sous le nom de « crise d’ébullition“. Étant donné qu’au-delà du point CHF, le coefficient de transfert de chaleur diminue, la transition vers l’ébullition du film est généralement inévitable.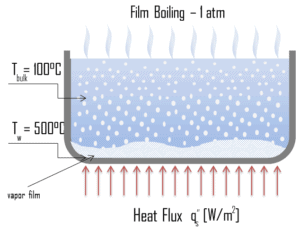 Faire bouillir le film. Une nouvelle augmentation du flux de chaleur fait qu’un film de vapeur recouvre la surface. Cela réduit considérablement le coefficient de convection, car la couche de vapeur a une capacité de transfert de chaleur nettement inférieure. En conséquence, la température excessive atteint une valeur très élevée. Au-delà du point Leidenfrost , un film de vapeur continu recouvre la surface et il n’y a aucun contact entre la phase liquide et la surface. Dans cette situation, le transfert de chaleur se fait à la fois par rayonnement et par conduction vers la vapeur. Si le matériau n’est pas suffisamment solide pour résister à cette température, l’équipement tombera en panne en endommageant le matériau. Ce phénomène est également connu sous le nom de burn out. Dans les réacteurs à eau sous pression, l’une des principales exigences de sécurité (peut-être la plus importante) est qu’aucun écart par rapport à l’ébullition nucléée ( DNB ) ne se produira pendant le fonctionnement en régime permanent, les transitoires opérationnels normaux et les événements opérationnels prévus (AOO). L’intégrité de la gaine de combustible sera maintenue si le DNBR minimum reste supérieur à la limite DNBR 95/95 pour les REP (une probabilité de 95% à un niveau de confiance de 95%). Étant donné que ce phénomène détériore le coefficient de transfert de chaleur et que le flux de chaleur reste, la chaleur s’accumule ensuite dans le crayon de combustible, provoquant une augmentation spectaculaire de la gaine et de la température du combustible. Simplement, une différence de température très élevée est nécessaire pour transférer le flux de chaleur critique produit de la surface du crayon de combustible au réfrigérant du réacteur (à travers la couche de vapeur).
Faire bouillir le film. Une nouvelle augmentation du flux de chaleur fait qu’un film de vapeur recouvre la surface. Cela réduit considérablement le coefficient de convection, car la couche de vapeur a une capacité de transfert de chaleur nettement inférieure. En conséquence, la température excessive atteint une valeur très élevée. Au-delà du point Leidenfrost , un film de vapeur continu recouvre la surface et il n’y a aucun contact entre la phase liquide et la surface. Dans cette situation, le transfert de chaleur se fait à la fois par rayonnement et par conduction vers la vapeur. Si le matériau n’est pas suffisamment solide pour résister à cette température, l’équipement tombera en panne en endommageant le matériau. Ce phénomène est également connu sous le nom de burn out. Dans les réacteurs à eau sous pression, l’une des principales exigences de sécurité (peut-être la plus importante) est qu’aucun écart par rapport à l’ébullition nucléée ( DNB ) ne se produira pendant le fonctionnement en régime permanent, les transitoires opérationnels normaux et les événements opérationnels prévus (AOO). L’intégrité de la gaine de combustible sera maintenue si le DNBR minimum reste supérieur à la limite DNBR 95/95 pour les REP (une probabilité de 95% à un niveau de confiance de 95%). Étant donné que ce phénomène détériore le coefficient de transfert de chaleur et que le flux de chaleur reste, la chaleur s’accumule ensuite dans le crayon de combustible, provoquant une augmentation spectaculaire de la gaine et de la température du combustible. Simplement, une différence de température très élevée est nécessaire pour transférer le flux de chaleur critique produit de la surface du crayon de combustible au réfrigérant du réacteur (à travers la couche de vapeur).
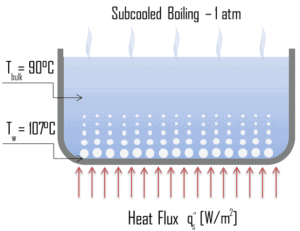 Catégorisation par la température de sous- refroidissement, ΔT sub .
Catégorisation par la température de sous- refroidissement, ΔT sub .
L’ébullition peut également être classée selon qu’elle est sous-refroidie ou saturée:
- Ébullition sous-refroidie. En ébullition sous-refroidie , la température de la majeure partie du liquide est inférieure à la température de saturation et les bulles formées à la surface peuvent se condenser dans le liquide. Cette condensation (effondrement) produit un son de fréquence ~ 100 Hz – 1 KHz. C’est pourquoi une bouilloire électrique fait le plus de bruit avant que l’eau arrive à ébullition saturée. Le terme sous- refroidissement fait référence à un liquide existant à une température inférieure à son point d’ébullition normal.
- Ébullition saturée . En ébullition saturée (également appelée ébullition en vrac ), la température du liquide dépasse légèrement la température de saturation. Une ébullition en masse peut se produire lorsque la température du système augmente ou que la pression du système chute au point d’ébullition. À ce stade, les bulles entrant dans le canal de refroidissement ne s’effondreront pas. Les bulles auront tendance à se rejoindre et à former de plus grosses bulles de vapeur. Les bulles de vapeur sont ensuite propulsées à travers le liquide par les forces de flottabilité, pour finalement s’échapper d’une surface libre.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci