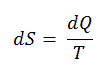Várias declarações da Segunda Lei da Termodinâmica
A segunda lei da termodinâmica pode ser expressa de várias maneiras específicas. Cada declaração expressa a mesma lei. Listados abaixo estão três frequentemente encontrados.
Antes dessas declarações, devemos lembrar o trabalho de um engenheiro e físico francês, Nicolas Léonard Sadi Carnot, que avançou o estudo da segunda lei, formando um princípio ( também chamado de regra de Carnot ) que especifica limites para a máxima eficiência que qualquer motor térmico pode obter .
Clausius Declaração da Segunda Lei
 Uma das primeiras declarações da Segunda Lei da Termodinâmica foi feita por R. Clausius em 1850 . Ele afirmou o seguinte.
Uma das primeiras declarações da Segunda Lei da Termodinâmica foi feita por R. Clausius em 1850 . Ele afirmou o seguinte.
“É impossível construir um dispositivo que opere em um ciclo e cujo único efeito seja a transferência de calor de um corpo mais frio para um corpo mais quente”.
O calor não pode fluir espontaneamente do sistema frio para o sistema quente sem que seja executado um trabalho externo no sistema. É exatamente isso que os refrigeradores e as bombas de calor realizam. Em uma geladeira, o calor flui do frio para o quente, mas somente quando forçado por um trabalho externo, as geladeiras são acionadas por motores elétricos que exigem trabalho do ambiente para operar.
As declarações Clausius e Kelvin-Planck demonstraram ser equivalentes.
Declaração da Segunda Lei de Kelvin-Planck
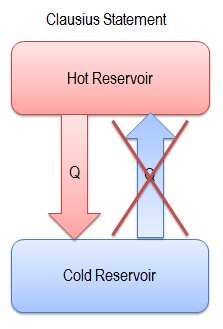
 “É impossível construir um dispositivo que opera em um ciclo e não produz outro efeito senão a produção de trabalho e a transferência de calor de um único corpo”.
“É impossível construir um dispositivo que opera em um ciclo e não produz outro efeito senão a produção de trabalho e a transferência de calor de um único corpo”.
Esta declaração opera com o termo ” reservatório térmico ” ou ” reservatório único “. Um reservatório é um objeto grande, no qual a temperatura permanece constante enquanto a energia é extraída. Esse sistema pode ser aproximado de várias maneiras – pela atmosfera da Terra, grandes massas de água como lagos, oceanos e assim por diante.
A declaração Kelvin-Planck não exclui a existência de um sistema que desenvolve uma quantidade líquida de trabalho a partir de uma transferência de calor extraída de um reservatório térmico. De acordo com esta declaração, um sistema em ciclo não pode desenvolver uma quantidade líquida positiva de trabalho a partir de uma transferência de calor extraída de um reservatório térmico.
Entropia e a Segunda Lei
Uma conseqüência da segunda lei da termodinâmica é o desenvolvimento da propriedade física da matéria, conhecida como entropia (S) . A alteração nesta propriedade é usada para determinar a direção na qual um determinado processo continuará. A entropia quantifica a energia de uma substância que não está mais disponível para realizar um trabalho útil . Isso se refere à segunda lei, uma vez que a segunda lei prevê que nem todo o calor fornecido a um ciclo pode ser transformado em uma quantidade igual de trabalho; alguma rejeição de calor deve ocorrer.
Veja também: Entropia
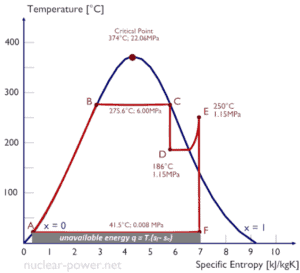
Segundo Clausius, a entropia foi definida através da mudança na entropia S de um sistema. A mudança na entropia S, quando uma quantidade de calor Q é adicionada a ela por um processo reversível a temperatura constante, é dada por:
Aqui Q é a energia transferida como calor para ou do sistema durante o processo, e T é a temperatura do sistema em Kelvins durante o processo. A unidade SI de entropia é J / K .
A segunda lei da termodinâmica também pode ser expressa como ∆S≥0 para um ciclo fechado.
Em palavras:
A entropia de qualquer sistema isolado nunca diminui. Em um processo termodinâmico natural, a soma das entropias dos sistemas termodinâmicos em interação aumenta.
∆S≥0
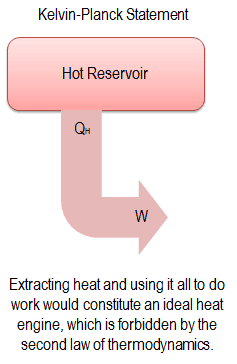
Como a entropia diz muito sobre a utilidade de uma quantidade de calor transferida na execução do trabalho, as tabelas de vapor incluem valores de entropia específica (s = S / m) como parte das informações tabuladas.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.