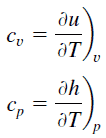Energia interna de um gás ideal
A energia interna é o total de toda a energia associada ao movimento dos átomos ou moléculas no sistema. As formas microscópicas de energia incluem aquelas devidas à rotação , vibração , tradução e interações entre as moléculas de uma substância.
Gás Monatômico – Energia Interna
Para um gás ideal monatômico (como hélio, néon ou argônio), a única contribuição para a energia vem da energia cinética translacional . A energia cinética translacional média de um único átomo depende apenas da temperatura do gás e é dada pela equação:
K méd = 3/2 kT.
A energia interna de n moles de um gás monatômico ideal (um átomo por molécula) é igual à energia cinética média por molécula vezes o número total de moléculas, N:
E int = 3/2 NkT = 3/2 nRT
onde n é o número de moles. Cada direção (x, ye z) contribui (1/2) nRT para a energia interna . É aqui que entra a idéia da equipartição de energia – qualquer outra contribuição para a energia também deve contribuir (1/2) nRT . Como pode ser visto, a energia interna de um gás ideal depende apenas da temperatura e do número de mols de gás.
Molécula Diatômica – Energia Interna
Se as moléculas de gás contêm mais de um átomo, existem três direções de translação e a energia cinética rotacional também contribui, mas apenas para rotações em torno de dois dos três eixos perpendiculares. As cinco contribuições para a energia (cinco graus de liberdade) fornecem:
Gás ideal diatômico:
E int = 5/2 NkT = 5/2 nRT
Esta é apenas uma aproximação e se aplica a temperaturas intermediárias. Em baixas temperaturas, apenas a energia cinética translacional contribui e, em temperaturas mais altas, duas contribuições adicionais (energia cinética e potencial) vêm da vibração. A energia interna será maior a uma determinada temperatura do que para um gás monatômico, mas ainda será uma função apenas da temperatura para um gás ideal.
A energia interna dos gases reais também depende principalmente da temperatura, mas, da mesma forma que a Lei do Gás Ideal , a energia interna dos gases reais também depende um pouco da pressão e do volume . Todos os gases reais se aproximam do estado ideal a baixas pressões (densidades). A baixas pressões, as moléculas estão suficientemente afastadas para que não interajam. A energia interna de líquidos e sólidos é bastante complicada, pois inclui energia potencial elétrica associada às forças (ou ligações químicas ) entre átomos e moléculas.
Calor específico a volume constante e pressão constante
O calor específico é uma propriedade relacionada à energia interna que é muito importante na termodinâmica. As propriedades intensivas c v e c p são definidas para substâncias compressíveis puras e simples como derivados parciais da energia interna u (T, v) e entalpia h (T, p) , respectivamente:
onde os subscritos v e p denotam as variáveis mantidas fixas durante a diferenciação. As propriedades c v e c p são referidos como calores específicos (ou capacidades de calor ), porque, sob determinadas condições especiais dizem respeito a mudança de temperatura de um sistema para a quantidade de energia adicionada pela transferência de calor. As suas unidades SI são J / kg K ou J / mol K . Dois aquecimentos específicos são definidos para gases, um para volume constante (c v ) e outro para pressão constante (c p ) .
 De acordo com a primeira lei da termodinâmica , para processos de volume constante com um gás ideal monatômico, o calor molar específico será:
De acordo com a primeira lei da termodinâmica , para processos de volume constante com um gás ideal monatômico, o calor molar específico será:
C v = 3 / 2R = 12,5 J / mol K
Porque
U = 3 / 2nRT
Pode-se derivar que o calor molar específico a pressão constante é:
C p = C v + R = 5 / 2R = 20,8 J / mol K
Este C p é maior do que o calor específico molar a volume constante C v , porque a energia deve agora ser fornecidos não só para aumentar a temperatura do gás, mas também para o gás de trabalho para fazer porque neste volume caso alterações.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.