Enthalpie en unités intensives – Enthalpie spécifique
L’ enthalpie peut être transformée en une variable intensive ou spécifique en divisant par la masse . Les ingénieurs utilisent l’ enthalpie spécifique dans l’analyse thermodynamique plus que l’enthalpie elle-même. L’enthalpie spécifique (h) d’une substance est son enthalpie par unité de masse. Cela équivaut à l’enthalpie totale (H) divisée par la masse totale (m).
h = H / m
où:
h = enthalpie spécifique (J / kg)
H = enthalpie (J)
m = masse (kg)
Notez que l’enthalpie est la quantité thermodynamique équivalente au contenu thermique total d’un système. L’enthalpie spécifique est égale à l’ énergie interne spécifique du système plus le produit de la pression et du volume spécifique .
h = u + pv
En général, l’enthalpie est une propriété d’une substance , comme la pression, la température et le volume, mais elle ne peut pas être mesurée directement. Normalement, l’enthalpie d’une substance est donnée par rapport à une valeur de référence. Par exemple, l’enthalpie spécifique de l’eau ou de la vapeur est donnée en utilisant la référence suivante: l’enthalpie spécifique de l’eau est nulle à 0,01 ° C et à la pression atmosphérique normale , où h L = 0,00 kJ / kg . Le fait que la valeur absolue de l’enthalpie spécifique soit inconnue ne pose toutefois pas de problème, car c’est le changement d’enthalpie spécifique (∆h) et non la valeur absolue qui importe dans les problèmes pratiques.
Voir aussi: Tables à vapeur
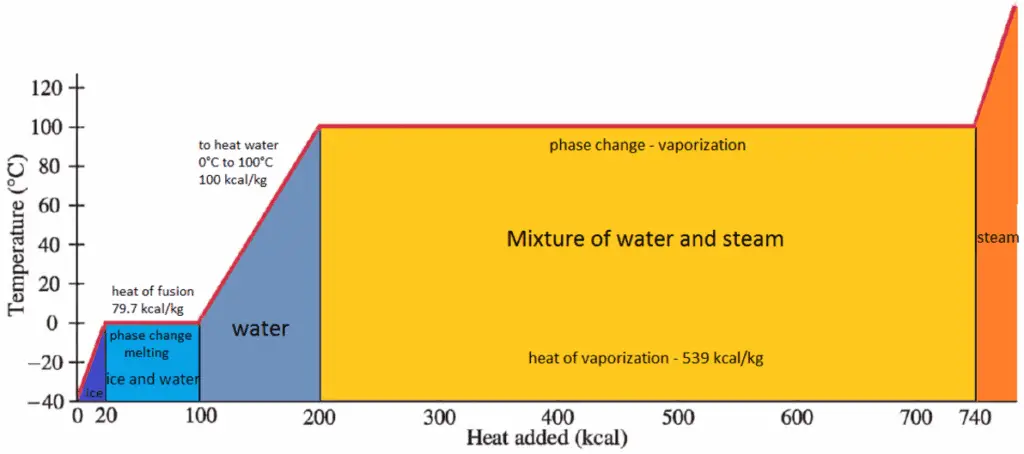
Enthalpie de vaporisation
En général, lorsqu’un matériau change de phase du solide au liquide, ou du liquide au gaz, une certaine quantité d’énergie est impliquée dans ce changement de phase. En cas de changement de phase liquide en gaz, cette quantité d’énergie est connue sous le nom d’ enthalpie de vaporisation , (symbole ∆H vap ; unité: J) également connue sous le nom de chaleur (latente) de vaporisation ou chaleur d’évaporation. La chaleur latente est la quantité de chaleur ajoutée ou retirée d’une substance pour produire un changement de phase. Cette énergie décompose les forces d’attraction intermoléculaires, et doit également fournir l’énergie nécessaire à l’expansion du gaz (le travail pΔV). Lorsque de la chaleur latente est ajoutée, aucun changement de température ne se produit. L’enthalpie de vaporisation est fonction de la pression à laquelle cette transformation a lieu.
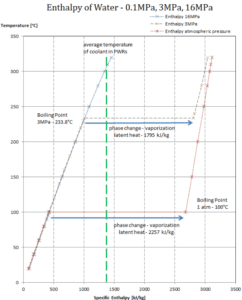
Chaleur latente de vaporisation – eau à 0,1 MPa (pression atmosphérique)
h lg = 2257 kJ / kg
Chaleur latente de vaporisation – eau à 3 MPa (pression à l’intérieur d’un générateur de vapeur)
h lg = 1795 kJ / kg
Chaleur latente de vaporisation – eau à 16 MPa (pression à l’intérieur d’un pressuriseur )
h lg = 931 kJ / kg
La chaleur de vaporisation diminue avec l’augmentation de la pression, tandis que le point d’ébullition augmente. Elle disparaît complètement à un certain point appelé le point critique . Au-dessus du point critique, les phases liquide et vapeur sont indiscernables et la substance est appelée fluide supercritique .
La chaleur de vaporisation est la chaleur nécessaire pour vaporiser complètement une unité de liquide saturé (ou condenser une unité de masse de vapeur saturée) et elle est égale à h lg = h g – h l .
La chaleur nécessaire pour faire fondre (ou geler) une masse unitaire à la substance à pression constante est la chaleur de fusion et est égale à h sl = h l – h s , où h s est l’enthalpie du solide saturé et h l est l’enthalpie du liquide saturé.
Enthalpie spécifique de vapeur humide
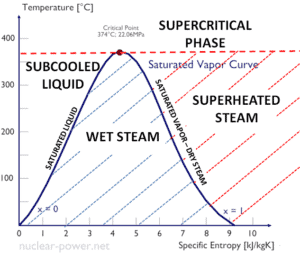 L’ enthalpie spécifique de l’eau liquide saturée (x = 0) et de la vapeur sèche (x = 1) peut être choisie dans les tables de vapeur. En cas de vapeur humide , l’enthalpie réelle peut être calculée avec la qualité de la vapeur, x , et les enthalpies spécifiques de l’eau liquide saturée et de la vapeur sèche:
L’ enthalpie spécifique de l’eau liquide saturée (x = 0) et de la vapeur sèche (x = 1) peut être choisie dans les tables de vapeur. En cas de vapeur humide , l’enthalpie réelle peut être calculée avec la qualité de la vapeur, x , et les enthalpies spécifiques de l’eau liquide saturée et de la vapeur sèche:
h humide = h s x + (1 – x) h l
où
h humide = enthalpie de vapeur humide (J / kg)
h s = enthalpie de vapeur «sèche» (J / kg)
h l = enthalpie de l’eau liquide saturée (J / kg)
Comme on peut le voir, la vapeur humide aura toujours une enthalpie plus faible que la vapeur sèche.
Exemple:
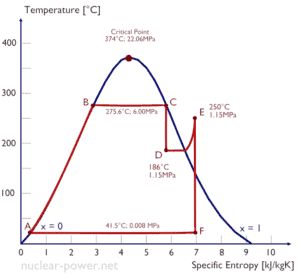
Un étage haute pression de turbine à vapeur fonctionne à l’état stable avec des conditions d’entrée de 6 MPa, t = 275,6 ° C, x = 1 (point C). La vapeur sort de cet étage de turbine à une pression de 1,15 MPa, 186 ° C et x = 0,87 (point D). Calculez la différence d’enthalpie entre ces deux états.
L’enthalpie pour l’état C peut être prélevée directement dans les tables de vapeur, tandis que l’enthalpie pour l’état D doit être calculée en utilisant la qualité de la vapeur:
h 1, humide = 2785 kJ / kg
h 2, humide = h 2, s x + (1 – x) h 2, l = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci