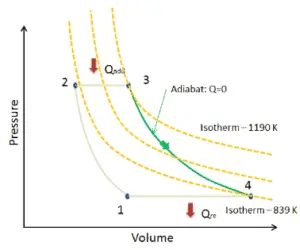
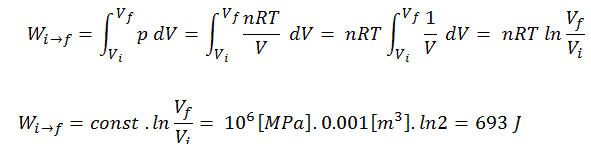Processo isotérmico
Um processo isotérmico é um processo termodinâmico , no qual a temperatura do sistema permanece constante (T = const). A transferência de calor para dentro ou para fora do sistema geralmente deve ocorrer a uma taxa tão lenta, a fim de se ajustar continuamente à temperatura do reservatório através da troca de calor. Em cada um desses estados, o equilíbrio térmico é mantido.
Para um gás ideal e um processo politrópico, o caso n = 1 corresponde a um processo isotérmico (temperatura constante). Em contraste com o processo adiabático , no qual n = κ e um sistema não trocam calor com o ambiente (Q = 0; ∆T ≠ 0 ) , em um processo isotérmico não há alteração na energia interna (devido a ∆T = 0 ) e, portanto, ΔU = 0 (para gases ideais) e Q ≠ 0. Um processo adiabático não é necessariamente um processo isotérmico, nem um processo isotérmico é necessariamente adiabático.
Na engenharia, mudanças de fase, como evaporação ou fusão, são processos isotérmicos quando, como geralmente ocorre, ocorrem a pressão e temperatura constantes.
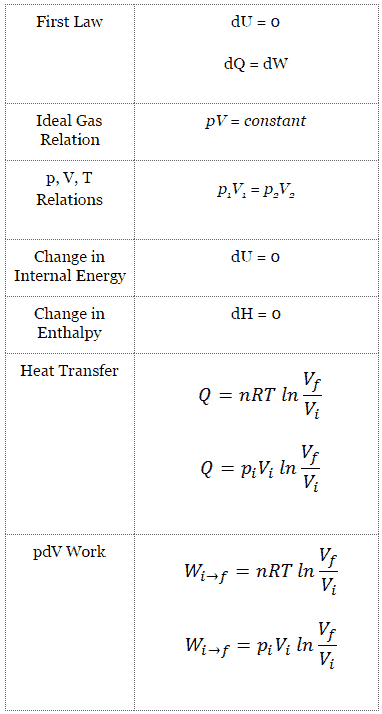

Expansão Isotérmica – Compressão Isotérmica
Veja também: O que é um gás ideal
Num gás ideal , as moléculas não têm volume e não interagem. De acordo com a lei ideal dos gases , a pressão varia linearmente com a temperatura e a quantidade e inversamente com o volume .
pV = nRT
Onde:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
O processo isotérmico pode ser expresso com a lei do gás ideal como:
pV = constante
ou
p 1 V 1 = p 2 V 2
Em um diagrama pV, o processo ocorre ao longo de uma linha (chamada uma isotérmica) que tem a equação p = constante / V .
Exemplo de processo isotérmico
Assuma uma expansão isotérmica de hélio (i → f) em um pistão sem atrito (sistema fechado). A expansão do gás é impulsionada pela absorção de energia térmica Q add . O gás se expande do volume inicial de 0,001 m 3 e simultaneamente a carga externa do pistão diminui lenta e continuamente de 1 MPa para 0,5 MPa. Como o hélio se comporta quase como um gás ideal, use a lei do gás ideal para calcular o volume final da câmara e depois calcule o trabalho realizado pelo sistema, quando a temperatura do gás for igual a 400 K.
Solução:
O volume final do gás, V f , pode ser calculado usando a relação p, V, T para o processo isotérmico:
p i V i = p f V f ⇒ V f = p i V i / p f = 2 x 0,001 m 3 = 0,002 m 3
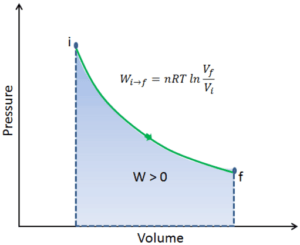
Para calcular esses processos, precisaríamos saber como a pressão varia com o volume do processo real pelo qual o sistema muda do estado i para o estado f . Como durante esse processo a pressão interna não era constante, o trabalho de p∆V realizado pelo pistão deve ser calculado usando a seguinte integral:
Por convenção, um valor positivo para o trabalho indica que o trabalho é realizado pelo sistema em seu entorno. Um valor negativo indica que o trabalho é realizado no sistema por seus arredores. O trabalho pΔV é igual à área sob a curva do processo plotada no diagrama pressão-volume.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.