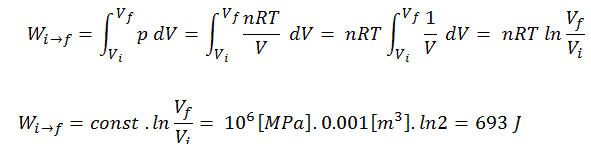Processo isotérmico
Um processo isotérmico é um processo termodinâmico , no qual a temperatura do sistema permanece constante (T = const). A transferência de calor para dentro ou para fora do sistema geralmente deve ocorrer a uma taxa tão lenta, a fim de se ajustar continuamente à temperatura do reservatório através da troca de calor. Em cada um desses estados, o equilíbrio térmico é mantido.
Para um gás ideal e um processo politrópico, o caso n = 1 corresponde a um processo isotérmico (temperatura constante). Ao contrário do processo adiabático , no qual n = κ e um sistema não trocam calor com o ambiente (Q = 0; ∆T ≠ 0 ) , em um processo isotérmico não há alteração na energia interna (devido a ∆T = 0 ) e, portanto, ΔU = 0 (para gases ideais) e Q ≠ 0. Um processo adiabático não é necessariamente um processo isotérmico, nem um processo isotérmico é necessariamente adiabático.
Na engenharia, mudanças de fase, como evaporação ou fusão, são processos isotérmicos quando, como geralmente ocorre, ocorrem a pressão e temperatura constantes.
Processo isotérmico e a primeira lei
A forma clássica da primeira lei da termodinâmica é a seguinte equação:
dU = dQ – dW
Nesta equação, dW é igual a dW = pdV e é conhecido como trabalho de fronteira .
No processo isotérmico e no gás ideal , todo o calor adicionado ao sistema será usado para realizar o trabalho:
Processo isotérmico (dU = 0):
dU = 0 = Q – W → W = Q (para gás ideal)

Expansão Isotérmica – Compressão Isotérmica
Veja também: O que é um gás ideal
 Num gás ideal , as moléculas não têm volume e não interagem. De acordo com a lei ideal dos gases , a pressão varia linearmente com a temperatura e a quantidade e inversamente com o volume .
Num gás ideal , as moléculas não têm volume e não interagem. De acordo com a lei ideal dos gases , a pressão varia linearmente com a temperatura e a quantidade e inversamente com o volume .
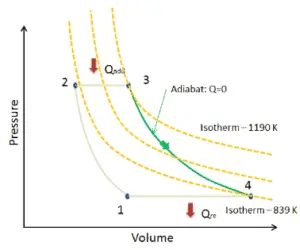
pV = nRT
Onde:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
O processo isotérmico pode ser expresso com a lei do gás ideal como:
pV = constante
ou
p 1 V 1 = p 2 V 2
Em um diagrama pV, o processo ocorre ao longo de uma linha (chamada uma isotérmica) que tem a equação p = constante / V .
Lei de Boyle-Mariotte
A lei de Boyle-Mariotte é uma das leis de gás . No final do século XVII, Robert William Boyle e Edme Mariotte estudaram independentemente a relação entre o volume e a pressão de um gás a temperatura constante . Os resultados de certas experiências com gases sob pressão relativamente baixa levaram Robert Boyle a formular uma lei bem conhecida. Afirma que:
Para uma massa fixa de gás a temperatura constante, o volume é inversamente proporcional à pressão.
Isso significa que, por exemplo, se você aumentar o volume 10 vezes, a pressão diminuirá 10 vezes. Se você reduzir pela metade o volume, dobrará a pressão.
Você pode expressar isso matematicamente como:
pV = constante
ou
p 1 V 1 = p 2 V 2
Sim, parece ser idêntico ao processo isotérmico do gás ideal. De fato, durante seus experimentos, a temperatura permanece constante, como foi assumido por Mariotte. Esses resultados são totalmente consistentes com a lei ideal dos gases , que determina que a constante é igual a nRT .
pV = nRT
Onde:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
Exemplo de processo isotérmico
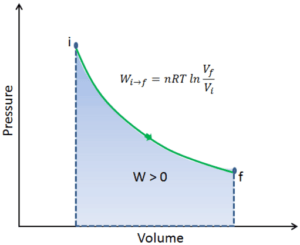
Assuma uma expansão isotérmica de hélio (i → f) em um pistão sem atrito (sistema fechado). A expansão do gás é impulsionada pela absorção de energia térmica Q add . O gás se expande do volume inicial de 0,001 m 3 e simultaneamente a carga externa do pistão diminui lenta e continuamente de 1 MPa para 0,5 MPa. Como o hélio se comporta quase como um gás ideal, use a lei do gás ideal para calcular o volume final da câmara e depois calcule o trabalho realizado pelo sistema, quando a temperatura do gás for igual a 400 K.
Solução:
O volume final do gás, V f , pode ser calculado usando a relação p, V, T para o processo isotérmico:
p i V i = p f V f ⇒ V f = p i V i / p f = 2 x 0,001 m 3 = 0,002 m 3
Para calcular esses processos, precisaríamos saber como a pressão varia com o volume do processo real pelo qual o sistema muda do estado i para o estado f . Como durante esse processo a pressão interna não era constante, o trabalho de p∆V realizado pelo pistão deve ser calculado usando a seguinte integral:
Por convenção, um valor positivo para o trabalho indica que o trabalho é realizado pelo sistema em seu entorno. Um valor negativo indica que o trabalho é realizado no sistema por seus arredores. O trabalho pΔV é igual à área sob a curva do processo plotada no diagrama pressão-volume.
Expansão Livre – Expansão Joule
Esses são processos adiabáticos nos quais nenhuma transferência de calor ocorre entre o sistema e seu ambiente e nenhum trabalho é realizado no sistema. Esses tipos de processos adiabáticos são chamados de expansão livre . É um processo irreversível no qual um gás se expande para uma câmara evacuada isolada. É também chamado de expansão Joule . Para um gás ideal, a temperatura não muda (isso significa que o processo também é isotérmico ) ; no entanto, os gases reais sofrem uma mudança de temperatura durante a expansão livre. Na expansão livre Q = W = 0, e a primeira lei exige que:
dE int = 0
Uma expansão livre não pode ser plotada em um diagrama PV, porque o processo é rápido, não quase estático. Os estados intermediários não são estados de equilíbrio e, portanto, a pressão não está claramente definida.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.