Leis da Termodinâmica
Existem quatro leis da termodinâmica que definem quantidades físicas fundamentais (temperatura, energia e entropia) e que caracterizam os sistemas termodinâmicos em equilíbrio térmico . Essas são consideradas uma das leis mais importantes de toda a física. As leis são as seguintes:
Se dois sistemas estão em equilíbrio térmico com um terço, eles estão em equilíbrio térmico entre si.
Esta lei fornece uma definição e método para definir temperaturas, talvez a propriedade intensiva mais importante de um sistema ao lidar com problemas de conversão de energia térmica.
Primeira lei da termodinâmica:
O aumento da energia interna de um sistema fechado é igual ao calor fornecido ao sistema menos o trabalho realizado por ele.
Esta lei é o princípio da conservação de energia . É a lei mais importante para análise da maioria dos sistemas e a que quantifica como a energia térmica é transformada em outras formas de energia . Segue-se que máquinas perpétuas de movimento do primeiro tipo são impossíveis.
A entropia de qualquer sistema isolado nunca diminui. Em um processo termodinâmico natural, a soma das entropias dos sistemas termodinâmicos em interação aumenta.
Esta lei indica a irreversibilidade dos processos naturais . Processos reversíveis são uma ficção teórica útil e conveniente, mas não ocorrem na natureza. A partir desta lei, é impossível construir um dispositivo que opere em um ciclo e cujo único efeito seja a transferência de calor de um corpo mais frio para um corpo mais quente. Segue-se que máquinas perpétuas de movimento do segundo tipo são impossíveis.
Terceira lei da termodinâmica:
A entropia de um sistema se aproxima de um valor constante, à medida que a temperatura se aproxima do zero absoluto.
Com base em evidências empíricas, essa lei afirma que a entropia de uma substância cristalina pura é zero no zero absoluto da temperatura , 0 K e que é impossível por meio de qualquer processo, não importa o ideal, reduzir a temperatura de um sistema para zero absoluto em um número finito de etapas. Isso nos permite definir um ponto zero para a energia térmica de um corpo.
Versão popular das leis da termodinâmica
0. Você deve jogar o jogo.
1. Você não pode vencer; você só pode empatar.
2. Você só pode empatar no zero absoluto.
3. Você não pode alcançar o zero absoluto.
Trabalho e Calor em Termodinâmica
Calor na Termodinâmica
Veja também: Calor na termodinâmica
Veja também: Trabalho em termodinâmica
Enquanto energia interna se refere à energia total de todas as moléculas dentro do objeto, o calor é a quantidade de energia que flui de um corpo para outro espontaneamente devido à diferença de temperatura. O calor é uma forma de energia, mas é energia em trânsito . O calor não é propriedade de um sistema. No entanto, a transferência de energia como calor ocorre no nível molecular como resultado de uma diferença de temperatura .
Considere um bloco de metal em alta temperatura, que consiste em átomos que oscilam intensamente em torno de suas posições médias. A baixas temperaturas , os átomos continuam a oscilar, mas com menos intensidade . Se um bloco mais quente de metal é colocado em contato com um bloco mais frio, os átomos intensamente oscilantes na borda do bloco mais quente emitem sua energia cinética para os átomos menos oscilantes na borda do bloco frio. Nesse caso, há transferência de energia entre esses dois blocos e o calor flui do bloco mais quente para o mais frio por essas vibrações aleatórias.
Em geral, quando dois objetos são colocados em contato térmico , o calor flui entre eles até que entrem em equilíbrio um com o outro. Quando existe uma diferença de temperatura , o calor flui espontaneamente do sistema mais quente para o sistema mais frio . A transferência de calor ocorre por condução ou por radiação térmica . Quando o fluxo de calor para , diz-se que está na mesma temperatura . Dizem que eles estão em equilíbrio térmico .
Como no trabalho, a quantidade de calor transferida depende do caminho e não simplesmente das condições iniciais e finais do sistema. Na verdade, existem muitas maneiras de levar o gás do estado i para o estado f.
Além disso, como no trabalho, é importante distinguir entre o calor adicionado a um sistema do ambiente e o calor removido do sistema para o ambiente. Q é positivo para o calor adicionado ao sistema, portanto, se o calor sai do sistema, Q é negativo. Como W na equação é o trabalho realizado pelo sistema, se o trabalho for realizado no sistema, W será negativo e E int aumentará.
O símbolo q é usado algumas vezes para indicar o calor adicionado ou removido de um sistema por unidade de massa . É igual ao calor total (Q) adicionado ou removido dividido pela massa (m).
Trabalho em Termodinâmica
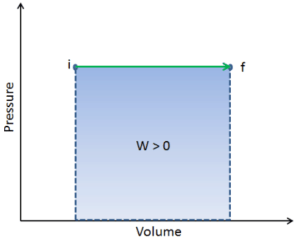
Na termodinâmica, o trabalho realizado por um sistema é a energia transferida pelo sistema para os arredores. Energia cinética, energia potencial e energia interna são formas de energia que são propriedades de um sistema. O trabalho é uma forma de energia , mas é energia em trânsito . Um sistema não contém trabalho, trabalho é um processo realizado por ou em um sistema. Em geral, o trabalho é definido para sistemas mecânicos como a ação de uma força sobre um objeto a distância.
W = F. d
Onde:
W = trabalho (J)
F = força (N)
d = deslocamento (m)
Motores de calor e eficiência térmica
As fontes de energia sempre desempenharam um papel muito importante no desenvolvimento da sociedade humana. A energia é geralmente definida como o potencial de trabalhar ou produzir calor . Às vezes, é como a “moeda” para executar o trabalho. Uma das propriedades mais maravilhosas do universo é que a energia pode ser transformada de um tipo para outro e transferida de um objeto para outro .
Em geral, é fácil produzir energia térmica realizando trabalhos , por exemplo, por qualquer processo de atrito. Mas conseguir trabalho com energia térmica é mais difícil . Está intimamente associado ao conceito de entropia . Por exemplo, a eletricidade é particularmente útil, pois possui entropia muito baixa (é altamente ordenada) e pode ser convertida em outras formas de energia com muita eficiência .
Às vezes, a energia mecânica está diretamente disponível, por exemplo, energia eólica e hidrelétrica. Mas a maior parte de nossa energia vem da queima de combustíveis fósseis (carvão, petróleo e gás) e de reações nucleares . Atualmente, o combustível fóssil ainda é a fonte de energia predominante no mundo. Mas a queima de combustíveis fósseis gera apenas energia térmica , portanto, essas fontes de energia são chamadas de “ fontes de energia primária ”, que devem ser convertidas em fonte de energia secundária , chamadas de portadores de energia ( energia elétrica etc.). Para converter energia térmica em outra forma de energia, um motor térmico deve ser usado.
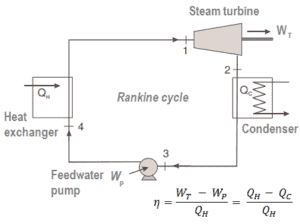
Em geral, um motor térmico é um dispositivo que converte energia química em calor ou energia térmica e depois em energia mecânica ou em energia elétrica. Muitos motores térmicos operam de maneira cíclica, adicionando energia na forma de calor em uma parte do ciclo e usando essa energia para realizar trabalhos úteis em outra parte do ciclo.
Por exemplo, como é típico em todas as usinas térmicas convencionais , o calor é usado para gerar vapor que aciona uma turbina a vapor conectada a um gerador que produz eletricidade. Geradores de vapor, turbinas a vapor, condensadores e bombas de água de alimentação constituem um motor térmico , sujeito às limitações de eficiência impostas pela segunda lei da termodinâmica . Nas modernas usinas nucleares, a eficiência termodinâmica geral é de cerca de um terço (33%); portanto, são necessários 3000 MWth de energia térmica da reação de fissão para gerar 1000 MWe de energia elétrica.
Veja também: Motores de calor
Eficiência térmica
Definimos a eficiência térmica , η th , de qualquer motor de calor como a razão entre o trabalho que faz, W , para o calor de entrada a uma temperatura elevada, Q H .
A eficiência térmica , η th , representa a fração de calor , Q H , que é convertida em trabalho . É uma medida de desempenho adimensional de um motor térmico que usa energia térmica, como uma turbina a vapor, um motor de combustão interna ou um refrigerador. Para uma refrigeração ou bombas de calor, a eficiência térmica indica até que ponto a energia adicionada pelo trabalho é convertida na produção líquida de calor. Como é um número sem dimensão, devemos sempre expressar W, Q H e Q C nas mesmas unidades.
Como a energia é conservada de acordo com a primeira lei da termodinâmica e a energia não pode ser convertida para funcionar completamente, a entrada de calor, Q H , deve ser igual ao trabalho realizado, W, mais o calor que deve ser dissipado como calor residual Q C no meio Ambiente. Portanto, podemos reescrever a fórmula da eficiência térmica como:
Para fornecer a eficiência em porcentagem, multiplicamos a fórmula anterior por 100. Observe que η th pode ser 100% apenas se o calor residual Q C for zero.
Em geral, a eficiência dos melhores motores térmicos é bastante baixa. Em suma, é muito difícil para converter energia térmica a energia mecânica . As eficiências térmicas geralmente são inferiores a 50% e geralmente muito abaixo. Tenha cuidado ao compará-lo com a eficiência da energia eólica ou hidrelétrica (turbinas eólicas não são motores de calor), não há conversão de energia entre a energia térmica e mecânica.
Veja também: Princípio de Carnot
Veja também: Eficiência térmica
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.


