Enthalpie in ausgedehnten Einheiten
H = U + pV
Die Enthalpie ist eine umfangreiche Menge, die von der Größe des Systems oder der Menge der darin enthaltenen Substanz abhängt. Die SI-Einheit der Enthalpie ist das Joule (J). Es ist die im System enthaltene Energie, ausgenommen die kinetische Bewegungsenergie des gesamten Systems und die potentielle Energie des gesamten Systems aufgrund externer Kraftfelder. Dies ist die thermodynamische Größe, die dem Gesamtwärmegehalt eines Systems entspricht.
Andererseits kann Energie in den chemischen Bindungen zwischen den Atomen gespeichert werden, aus denen die Moleküle bestehen. Dieser Energiespeicher auf atomarer Ebene umfasst Energie, die mit Elektronenorbitalzuständen, Kernspin und Bindungskräften im Kern verbunden ist.
Die Enthalpie wird durch das Symbol H dargestellt , und die Änderung der Enthalpie in einem Prozess ist H 2 – H 1 .
Es gibt Ausdrücke in Bezug auf bekanntere Variablen wie Temperatur und Druck :
dH = C p dT + V (1-αT) dp
Dabei ist C p die Wärmekapazität bei konstantem Druck und α der Koeffizient der (kubischen) Wärmeausdehnung. Für ideales Gas ist αT = 1 und daher:
dH = C p dT
Beispiel: Reibungsloser Kolben – Wärme – Enthalpie

Ein reibungsfreier Kolben wird verwendet, um einen konstanten Druck von 500 kPa in einem Zylinder bereitzustellen , der Dampf ( überhitzten Dampf ) mit einem Volumen von 2 m 3 bei 500 K enthält . Berechnen der Endtemperatur, falls 3000 kJ von Wärme hinzugefügt wird.
Lösung:
Anhand von Dampftabellen wissen wir, dass die spezifische Enthalpie eines solchen Dampfes (500 kPa; 500 K) etwa 2912 kJ / kg beträgt . Da der Dampf unter diesen Bedingungen eine Dichte von 2,2 kg / m 3 hat , wissen wir, dass sich bei einer Enthalpie von 2912 kJ / kg x 4,4 kg = 12812 kJ etwa 4,4 kg Dampf im Kolben befinden .
Wenn wir einfach Q = H 2 – H 1 verwenden , ist die resultierende Dampfenthalpie:
H 2 = H 1 + Q = 15812 kJ
Von Dampftabellen , wie Heißdampf (15812 / 4,4 = 3593 kJ / kg) wird eine Temperatur von haben 828 K (555 ° C) . Da der Dampf bei dieser Enthalpie eine Dichte von 1,31 kg / m 3 hat , ist es offensichtlich, dass er sich um etwa 2,2 / 1,31 = 1,67 (+ 67%) ausgedehnt hat. Daher beträgt das resultierende Volumen 2 m 3 × 1,67 = 3,34 m 3 und ∆V = 3,34 m 3 – 2 m 3 = 1,34 m 3 .
Der p∆V- Teil der Enthalpie, dh die geleistete Arbeit, ist:
W = p∆V = 500 000 Pa × 1,34 m 3 = 670 kJ
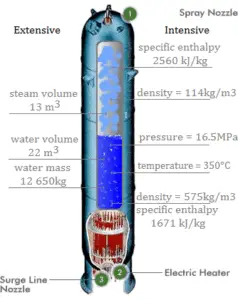
Beispiel: Energiebilanz in einem Dampferzeuger
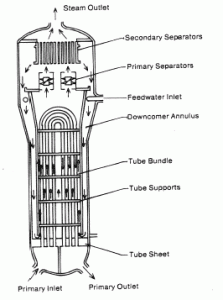
Berechnen Sie die Menge an Primärkühlmittel, die erforderlich ist, um 1 kg Speisewasser in einem typischen Dampferzeuger zu verdampfen . Angenommen, es gibt keine Energieverluste, dies ist nur ein idealisiertes Beispiel.
Gleichgewicht des Primärkreises
Das heiße Primärkühlmittel ( Wasser 330 ° C; 62 MP °; 16 MPa ) wird durch den Primäreinlass in den Dampferzeuger gepumpt . Das Primärkühlmittel verlässt (Wasser 295 ° C; 56 MP ° F; 16 MPa) den Dampferzeuger durch den Primärauslass.
h I, Einlass = 1516 kJ / kg
=> Δh I = -206 kJ / kg
h I, Auslass = 1310 kJ / kg
Gleichgewicht des Speisewassers
Das Speisewasser ( Wasser 230 ° C; 446 ° F; 6,5 MPa ) wird durch den Speisewassereinlass in den Dampferzeuger gepumpt . Das Speisewasser (Sekundärkreislauf) wird von ~ 230 ° C bis zum Siedepunkt dieser Flüssigkeit (280 ° C; 536 ° F; 6,5 MPa) erwärmt . Das Speisewasser wird dann verdampft und der Druckdampf ( Sattdampf 280 ° C; 6,5 MPa) verlässt den Dampferzeuger durch den Dampfauslass und gelangt weiter zur Dampfturbine.
h II, Einlass = 991 kJ / kg
=> Δh II = 1789 kJ / kg
h II, Auslass = 2780 kJ / kg
Gleichgewicht des Dampferzeugers
Da der Unterschied in den spezifischen Enthalpien für Primärkühlmittel geringer ist als für Speisewasser, ist es offensichtlich, dass die Menge an Primärkühlmittel höher als 1 kg sein wird. Zur Herstellung von 1 kg Sattdampf aus Speisewasser sind ca. 1789/206 x 1 kg = 8,68 kg Primärkühlmittel erforderlich.
Beispiel: Verbrennung von Wasserstoff
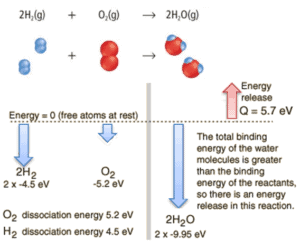
Betrachten Sie die Verbrennung von Wasserstoff in Luft. In einer in Luft brennenden Flamme aus reinem Wasserstoffgas reagiert der Wasserstoff (H 2 ) mit Sauerstoff (O 2 ) unter Bildung von Wasser (H 2 O) und setzt Energie frei .
Energetisch kann davon ausgegangen werden, dass der Prozess die Energie benötigt, um H 2 und O 2 zu dissoziieren , aber dann bringt die Bindung des H 2 O das System in einen gebundenen Zustand mit negativem Potential zurück . Es ist tatsächlich negativer als die gebundenen Zustände der Reaktanten, und die Bildung der beiden Wassermoleküle ist daher eine exotherme Reaktion , die 5,7 eV Energie freisetzt. In Worten der Enthalpie beträgt die Verbrennungsenthalpie –286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
In Worten der Enthalpie beträgt die Verbrennungsenthalpie –286 kJ / mol (Energie pro Mol molekularen Wasserstoffs):
2H 2 (g) + O 2 (g) → 2H 2 O ( 1 ) + 572 kJ
Das Gleichgewicht der Energie vor und nach der Reaktion kann schematisch mit dem Zustand dargestellt werden, in dem alle Atome frei sind, als Referenz für die Energie genommen.
Beispiel: Enthalpie von Nassdampf
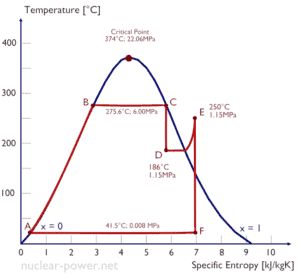
Eine Hochdruckstufe der Dampfturbine arbeitet im stationären Zustand mit Einlassbedingungen von 6 MPa, t = 275,6 ° C, x = 1 (Punkt C). Dampf verlässt diese Turbinenstufe mit einem Druck von 1,15 MPa, 186 ° C und x = 0,87 (Punkt D). Berechnen Sie die Enthalpiedifferenz zwischen diesen beiden Zuständen.
Die Enthalpie für den Zustand C kann direkt aus Dampftabellen entnommen werden , während die Enthalpie für den Zustand D anhand der Dampfqualität berechnet werden muss:
h 1, nass = 2785 kJ / kg
h 2, nass = h 2, s x + (1 – x) h 2, l = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.