Was ist Enthalpie?
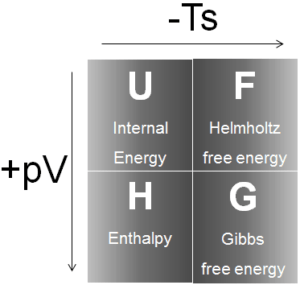
In der Thermodynamik ist die Enthalpie das Maß für die Energie in einem thermodynamischen System. Dies ist die thermodynamische Größe, die dem gesamten Wärmeinhalt eines Systems entspricht. Die Enthalpie ist definiert als die Summe der inneren Energie E plus dem Produkt aus Druck p und Volumen V. In vielen thermodynamischen Analysen erscheint die Summe der inneren Energie U und des Produkts aus Druck p und Volumen V als zweckmäßig um der Kombination einen Namen, eine Enthalpie und ein eindeutiges Symbol zu geben, H.
Die Enthalpie ist der bevorzugte Ausdruck von Systemenergieänderungen bei vielen chemischen, biologischen und physikalischen Messungen bei konstantem Druck . Es ist so nützlich, dass es in den Dampftabellen zusammen mit dem spezifischen Volumen und der spezifischen inneren Energie tabellarisch aufgeführt ist . Dies liegt an der Tatsache, dass es die Beschreibung der Energieübertragung vereinfacht . Bei konstantem Druck entspricht die Enthalpieänderung der Energie, die durch Erhitzen (Q = H 2 – H 1 ) oder andere Arbeiten als Expansionsarbeiten aus der Umgebung übertragen wird . Bei einem Prozess mit variablem Druck ist der Unterschied in der Enthalpie nicht ganz so offensichtlich.
Enthalpie in extensiven Einheiten
H = U + pV
Die Enthalpie ist eine große Menge, sie hängt von der Größe des Systems oder von der Menge der darin enthaltenen Substanz ab. Die SI-Einheit der Enthalpie ist das Joule (J). Es ist die im System enthaltene Energie, ohne die kinetische Bewegungsenergie des Gesamtsystems und die potentielle Energie des Gesamtsystems aufgrund externer Kraftfelder. Dies ist die thermodynamische Größe, die dem gesamten Wärmeinhalt eines Systems entspricht.
Andererseits kann Energie in den chemischen Bindungen zwischen den Atomen gespeichert werden, aus denen die Moleküle bestehen. Diese Energiespeicherung auf atomarer Ebene schließt Energie ein, die mit Elektronenorbitalzuständen, Kernspin und Bindungskräften im Kern verbunden ist.
Die Enthalpie wird durch das Symbol H dargestellt , und die Änderung der Enthalpie in einem Prozess ist H 2 – H 1 .
Es gibt Ausdrücke in Bezug auf bekanntere Variablen wie Temperatur und Druck :
dH = C p dT + V (1-αT) dp
Dabei ist C p die Wärmekapazität bei konstantem Druck und α der Koeffizient der (kubischen) Wärmeausdehnung. Für ideales Gas ist αT = 1 und daher:
dH = C p dT
Beispiel: Reibungsloser Kolben – Wärme – Enthalpie
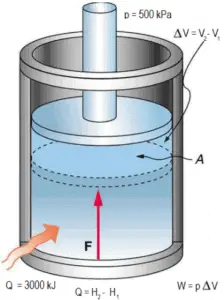
Ein reibungsfreier Kolben wird verwendet, um einen konstanten Druck von 500 kPa in einem Zylinder bereitzustellen , der Dampf ( überhitzten Dampf ) mit einem Volumen von 2 m 3 bei 500 K enthält . Berechnen der Endtemperatur, falls 3000 kJ von Wärme hinzugefügt wird.
Lösung:
Anhand von Dampftabellen wissen wir, dass die spezifische Enthalpie eines solchen Dampfes (500 kPa; 500 K) etwa 2912 kJ / kg beträgt . Da der Dampf unter diesen Bedingungen eine Dichte von 2,2 kg / m 3 hat , wissen wir, dass sich bei einer Enthalpie von 2912 kJ / kg x 4,4 kg = 12812 kJ etwa 4,4 kg Dampf im Kolben befinden .
Wenn wir einfach Q = H 2 – H 1 verwenden , ist die resultierende Dampfenthalpie:
H 2 = H 1 + Q = 15812 kJ
Von Dampftabellen , wie Heißdampf (15812 / 4,4 = 3593 kJ / kg) wird eine Temperatur von haben 828 K (555 ° C) . Da der Dampf bei dieser Enthalpie eine Dichte von 1,31 kg / m 3 hat , ist es offensichtlich, dass er sich um etwa 2,2 / 1,31 = 1,67 (+ 67%) ausgedehnt hat. Daher beträgt das resultierende Volumen 2 m 3 × 1,67 = 3,34 m 3 und ∆V = 3,34 m 3 – 2 m 3 = 1,34 m 3 .
Der p∆V- Teil der Enthalpie, dh die geleistete Arbeit, ist:
W = p∆V = 500 000 Pa × 1,34 m 3 = 670 kJ
Enthalpie in Intensiveinheiten – Spezifische Enthalpie
Die Enthalpie kann durch Teilen durch die Masse zu einer intensiven oder spezifischen Variablen gemacht werden . Ingenieure verwenden die spezifische Enthalpie in der thermodynamischen Analyse mehr als die Enthalpie selbst. Die spezifische Enthalpie (h) eines Stoffes ist seine Enthalpie pro Masseneinheit. Sie entspricht der Gesamtenthalpie (H) geteilt durch die Gesamtmasse (m).
h = H / m
wo:
h = spezifische Enthalpie (J / kg)
H = Enthalpie (J)
m = Masse (kg)
Beachten Sie, dass die Enthalpie die thermodynamische Größe ist, die dem Gesamtwärmegehalt eines Systems entspricht. Die spezifische Enthalpie entspricht der spezifischen inneren Energie des Systems plus dem Produkt aus Druck und spezifischem Volumen .
h = u + pv
Im Allgemeinen ist die Enthalpie eine Eigenschaft einer Substanz wie Druck, Temperatur und Volumen, kann jedoch nicht direkt gemessen werden. Normalerweise wird die Enthalpie eines Stoffes in Bezug auf einen Referenzwert angegeben. Zum Beispiel wird die spezifische Enthalpie von Wasser oder Dampf unter Verwendung der Referenz angegeben, dass die spezifische Enthalpie von Wasser bei 0,01 ° C und normalem atmosphärischem Druck Null ist , wobei h L = 0,00 kJ / kg ist . Die Tatsache, dass der Absolutwert der spezifischen Enthalpie unbekannt ist, ist jedoch kein Problem, da bei praktischen Problemen die Änderung der spezifischen Enthalpie (∆h) und nicht der Absolutwert wichtig ist.
Enthalpie bei chemischen Reaktionen
Die Enthalpie ist auch in der Chemie weit verbreitet . Chemische Reaktionen werden durch die Gesetze der Thermodynamik bestimmt . In der Thermodynamik ist die innere Energie eines Systems die im System enthaltene Energie, ausgenommen die kinetische Bewegungsenergie des gesamten Systems und die potentielle Energie des gesamten Systems aufgrund externer Kraftfelder. Die Enthalpie einer chemischen Reaktion ist definiert als die Enthalpieänderung, die in einem Bestandteil eines thermodynamischen Systems beobachtet wird, wenn ein Mol Substanz vollständig reagiert.
Da es sich bei den meisten chemischen Reaktionen im Labor um Prozesse mit konstantem Druck handelt, können wir die Änderung der Enthalpie (auch als Reaktionsenthalpie bezeichnet) für eine Reaktion schreiben. Die Reaktionsenthalpie kann positiv oder negativ oder null sein, abhängig davon, ob die Wärme gewonnen oder verloren wird oder keine Wärme verloren geht oder gewonnen wird. Bei einer endothermen Reaktion haben die Produkte mehr gespeicherte chemische Energie als die Reaktanten. Bei einer exothermen Reaktion ist das Gegenteil der Fall. Die Produkte haben weniger gespeicherte chemische Energie als die Reaktanten. Die überschüssige Energie wird im Allgemeinen an die Umgebung abgegeben, wenn die Reaktion stattfindet.
Bei chemischen Reaktionen wird Energie in den chemischen Bindungen zwischen den Atomen gespeichert , aus denen die Moleküle bestehen. Die Energiespeicherung auf atomarer Ebene umfasst Energie, die mit Elektronenorbitalzuständen verbunden ist. Unabhängig davon, ob eine chemische Reaktion Energie absorbiert oder freisetzt, ändert sich die Energiemenge während der Reaktion insgesamt nicht. Das liegt am Energieerhaltungsgesetz , das besagt:
Energie kann nicht erzeugt oder zerstört werden . Während einer chemischen Reaktion kann sich die Form der Energie ändern .
Verdampfungsenthalpie
Wenn ein Material die Phase von fest zu flüssig oder von flüssig zu gasförmig ändert, ist im Allgemeinen eine bestimmte Energiemenge an dieser Phasenänderung beteiligt. Im Falle eines Phasenwechsels von Flüssigkeit zu Gas wird diese Energiemenge als Verdampfungsenthalpie (Symbol ∆H vap ; Einheit: J) bezeichnet, die auch als (latente) Verdampfungswärme oder Verdampfungswärme bezeichnet wird. Latente Wärme ist die Wärmemenge, die einer Substanz hinzugefügt oder von ihr entfernt wird, um eine Phasenänderung zu erzeugen. Diese Energie baut die intermolekularen Anziehungskräfte auf und muss auch die Energie liefern, die zur Expansion des Gases erforderlich ist (die pΔV-Arbeit). Wenn latente Wärme hinzugefügt wird, tritt keine Temperaturänderung auf. Die Verdampfungsenthalpie ist eine Funktion des Drucks, bei dem diese Umwandlung stattfindet.
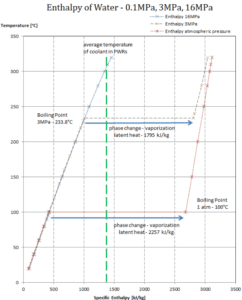
Latente Verdampfungswärme – Wasser mit 0,1 MPa (atmosphärischer Druck)
h lg = 2257 kJ / kg
Latente Verdampfungswärme – Wasser mit 3 MPa (Druck in einem Dampferzeuger)
h lg = 1795 kJ / kg
Verdampfungswärme – Wasser bei 16 MPa (Druck in einem Druckhalter )
h lg = 931 kJ / kg
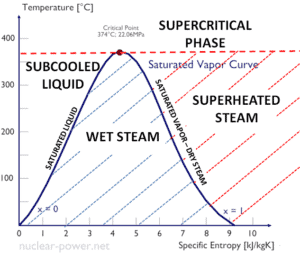
Die Verdampfungswärme nimmt mit zunehmendem Druck ab, während der Siedepunkt steigt. Es verschwindet vollständig an einem bestimmten Punkt, der als kritischer Punkt bezeichnet wird . Oberhalb des kritischen Punktes sind die flüssige und die dampfförmige Phase nicht zu unterscheiden, und die Substanz wird als überkritische Flüssigkeit bezeichnet .
Die Verdampfungswärme ist die Wärme, die erforderlich ist, um eine Einheit gesättigter Flüssigkeit vollständig zu verdampfen (oder eine Einheit Masse gesättigten Dampfes zu kondensieren) und gleich h lg = h g – h l .
Die Wärme, die erforderlich ist, um eine Masseeinheit an der Substanz bei konstantem Druck zu schmelzen (oder einzufrieren), ist die Schmelzwärme und ist gleich h sl = h l – h s , wobei h s die Enthalpie von gesättigtem Feststoff und h l ist ist die Enthalpie der gesättigten Flüssigkeit.
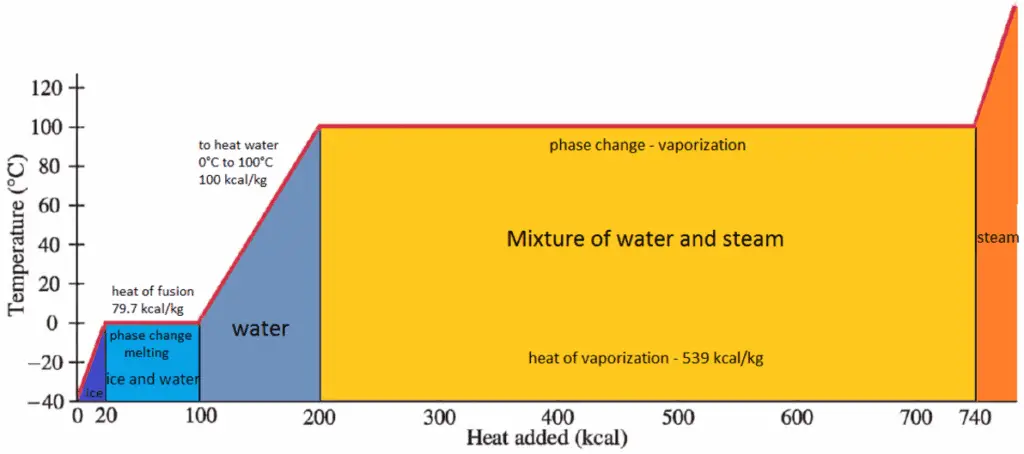
Spezifische Enthalpie von Nassdampf
 Die spezifische Enthalpie von gesättigtem flüssigem Wasser (x = 0) und trockenem Dampf (x = 1) kann aus Dampftabellen entnommen werden. Im Fall von Naßdampf kann die tatsächliche Enthalpie mit der berechnen Dampfqualität x , und den spezifischen Enthalpien gesättigten flüssigen Wasser und Trockendampf:
Die spezifische Enthalpie von gesättigtem flüssigem Wasser (x = 0) und trockenem Dampf (x = 1) kann aus Dampftabellen entnommen werden. Im Fall von Naßdampf kann die tatsächliche Enthalpie mit der berechnen Dampfqualität x , und den spezifischen Enthalpien gesättigten flüssigen Wasser und Trockendampf:
h nass = h s x + (1 – x) h l
wo
h nass = Enthalpie des feuchten Dampfes (J / kg)
h s = Enthalpie von “trockenem” Dampf (J / kg)
h l = Enthalpie von gesättigtem flüssigem Wasser (J / kg)
Wie zu sehen ist, hat nasser Dampf immer eine geringere Enthalpie als trockener Dampf.
Beispiel:
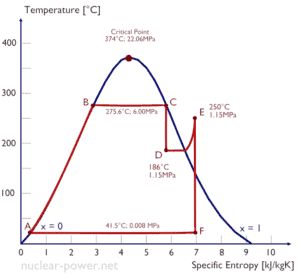
Eine Hochdruckstufe der Dampfturbine arbeitet im stationären Zustand mit Einlassbedingungen von 6 MPa, t = 275,6 ° C, x = 1 (Punkt C). Dampf verlässt diese Turbinenstufe mit einem Druck von 1,15 MPa, 186 ° C und x = 0,87 (Punkt D). Berechnen Sie die Enthalpiedifferenz zwischen diesen beiden Zuständen.
Die Enthalpie für den Zustand C kann direkt aus Dampftabellen entnommen werden, während die Enthalpie für den Zustand D anhand der Dampfqualität berechnet werden muss:
h 1, nass = 2785 kJ / kg
h 2, nass = h 2, s x + (1 – x) h 2, l = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.