Qu’est-ce que l’enthalpie?
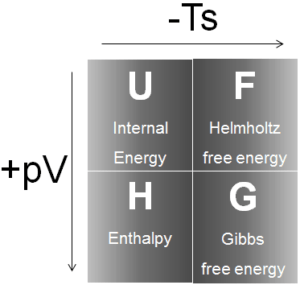
En thermodynamique, l’enthalpie est la mesure de l’énergie dans un système thermodynamique. C’est la quantité thermodynamique équivalente au contenu thermique total d’un système. L’ enthalpie est définie comme étant la somme de l’énergie interne E plus le produit de la pression p et du volume V. Dans de nombreuses analyses thermodynamiques, la somme de l’énergie interne U et du produit de la pression p et du volume V apparaît. donner à la combinaison un nom, une enthalpie et un symbole distinct, H.
L’enthalpie est l’expression préférée des changements d’énergie du système dans de nombreuses mesures chimiques, biologiques et physiques à pression constante . Il est si utile qu’il soit présenté dans les tableaux de vapeur avec un volume et une énergie interne spécifiques . Cela est dû au fait que cela simplifie la description du transfert d’énergie . À pression constante, le changement d’enthalpie est égal à l’énergie transférée de l’environnement par le chauffage (Q = H 2 – H 1 ) ou par des travaux autres que des travaux d’expansion. Pour un procédé à pression variable, la différence d’enthalpie n’est pas aussi évidente.
Enthalpie en unités extensives
H = U + pV
L’enthalpie est une quantité importante, elle dépend de la taille du système ou de la quantité de substance qu’il contient. L’unité SI d’enthalpie est le joule (J). C’est l’énergie contenue dans le système, à l’exclusion de l’énergie cinétique de mouvement du système dans son ensemble et de l’énergie potentielle du système dans son ensemble en raison des champs de forces externes. C’est la quantité thermodynamique équivalente au contenu thermique total d’un système.
D’autre part, de l’énergie peut être stockée dans les liaisons chimiques entre les atomes qui composent les molécules. Ce stockage d’énergie au niveau atomique inclut l’énergie associée aux états orbitaux des électrons, au spin nucléaire et aux forces de liaison dans le noyau.
L’enthalpie est représentée par le symbole H , et le changement d’enthalpie dans un processus est H 2 – H 1 .
Il existe des expressions en termes de variables plus familières telles que la température et la pression :
dH = C p dT + V (1-αT) dp
Où C p est la capacité thermique à pression constante et α est le coefficient de dilatation thermique (cubique). Pour un gaz parfait αT = 1 et donc:
dH = C p dT
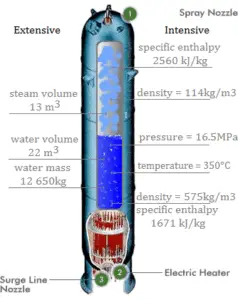
Exemple: Piston sans friction – Chaleur – Enthalpie
Un piston sans frottement est utilisé pour fournir une pression constante de 500 kPa en une vapeur contenant de cylindre ( vapeur surchauffée ) d’un volume de 2 m 3 à 500 K . Calculez la température finale, si 3000 kJ de chaleur sont ajoutés.
Solution:
En utilisant des tables à vapeur, nous savons que l’ enthalpie spécifique de cette vapeur (500 kPa; 500 K) est d’environ 2912 kJ / kg . Étant donné qu’à cette condition, la vapeur a une densité de 2,2 kg / m 3 , alors nous savons qu’il y a environ 4,4 kg de vapeur dans le piston à l’enthalpie de 2912 kJ / kg x 4,4 kg = 12812 kJ .
Lorsque nous utilisons simplement Q = H 2 – H 1 , l’enthalpie de vapeur résultante sera alors:
H 2 = H 1 + Q = 15812 kJ
À partir des tables à vapeur , une telle vapeur surchauffée (15812 / 4,4 = 3593 kJ / kg) aura une température de 828 K (555 ° C) . Comme à cette enthalpie, la vapeur a une densité de 1,31 kg / m 3 , il est évident qu’elle a augmenté d’environ 2,2 / 1,31 = 1,67 (+ 67%). Par conséquent, le volume résultant est de 2 m 3 x 1,67 = 3,34 m 3 et ∆V = 3,34 m 3 – 2 m 3 = 1,34 m 3 .
La partie p∆V de l’enthalpie, c’est-à-dire le travail effectué est:
W = p∆V = 500 000 Pa x 1,34 m 3 = 670 kJ
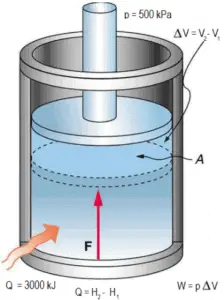
Enthalpie en unités intensives – Enthalpie spécifique
L’ enthalpie peut être transformée en une variable intensive ou spécifique , en la divisant par la masse . Les ingénieurs utilisent l’ enthalpie spécifique dans l’analyse thermodynamique plus que l’enthalpie elle-même. L’enthalpie spécifique (h) d’une substance est son enthalpie par unité de masse. Elle est égale à l’enthalpie totale (H) divisée par la masse totale (m).
h = H / m
où:
h = enthalpie spécifique (J / kg)
H = enthalpie (J)
m = masse (kg)
Notez que l’enthalpie est la quantité thermodynamique équivalente au contenu calorifique total d’un système. L’enthalpie spécifique est égale à l’ énergie interne spécifique du système plus le produit de la pression et du volume spécifique .
h = u + pv
En général, l’enthalpie est une propriété d’une substance , comme la pression, la température et le volume, mais elle ne peut pas être mesurée directement. Normalement, l’enthalpie d’une substance est donnée par rapport à une valeur de référence. Par exemple, l’enthalpie spécifique de l’eau ou de la vapeur est donnée en utilisant la référence selon laquelle l’enthalpie spécifique de l’eau est nulle à 0,01 ° C et à la pression atmosphérique normale , où h L = 0,00 kJ / kg . Le fait que la valeur absolue de l’enthalpie spécifique ne soit pas connue n’est cependant pas un problème, car c’est le changement d’enthalpie spécifique (∆h) et non la valeur absolue qui est important dans les problèmes pratiques.
Enthalpie dans les réactions chimiques
L’enthalpie est également largement utilisée en chimie. Les réactions chimiques sont déterminées par les lois de la thermodynamique . En thermodynamique, l’ énergie interne d’un système est l’énergie contenue dans le système, à l’exclusion de l’énergie cinétique de mouvement du système dans son ensemble et de l’énergie potentielle du système dans son ensemble en raison de champs de force externes. L’enthalpie d’une réaction chimique est définie comme le changement d’enthalpie observé dans un constituant d’un système thermodynamique lorsqu’une mole de substance réagit complètement.
Comme la plupart des réactions chimiques en laboratoire sont des processus à pression constante, nous pouvons écrire le changement d’enthalpie (également connu sous le nom d’enthalpie de réaction) pour une réaction. L’enthalpie de réaction peut être positive ou négative ou nulle selon que la chaleur est gagnée ou perdue ou qu’aucune chaleur n’est perdue ou gagnée. Dans une réaction endothermique , les produits ont plus d’énergie chimique stockée que les réactifs. Dans une réaction exothermique , l’inverse est vrai. Les produits ont moins d’énergie chimique stockée que les réactifs. L’excès d’énergie est généralement libéré dans l’environnement lorsque la réaction se produit.
Dans les réactions chimiques , l’énergie est stockée dans les liaisons chimiques entre les atomes qui composent les molécules. Le stockage d’énergie au niveau atomique comprend l’énergie associée aux états orbitaux des électrons. Qu’une réaction chimique absorbe ou libère de l’énergie, il n’y a pas de changement global de la quantité d’énergie pendant la réaction. C’est à cause de la loi de conservation de l’énergie , qui stipule que:
L’énergie ne peut pas être créée ou détruite . L’énergie peut changer de forme lors d’une réaction chimique .
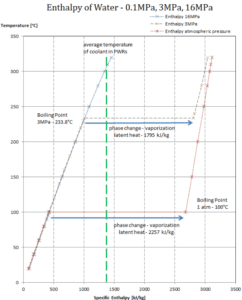
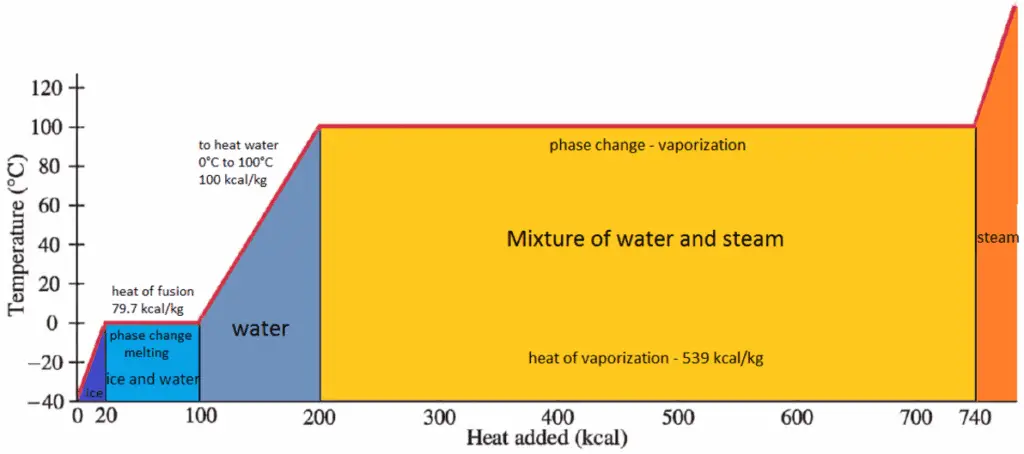
Enthalpie de vaporisation
En général, lorsqu’un matériau change de phase du solide au liquide, ou du liquide au gaz, une certaine quantité d’énergie est impliquée dans ce changement de phase. En cas de changement de phase liquide en gaz, cette quantité d’énergie est connue sous le nom d’ enthalpie de vaporisation , (symbole ∆H vap ; unité: J) également connue sous le nom de chaleur (latente) de vaporisation ou chaleur d’évaporation. La chaleur latente est la quantité de chaleur ajoutée ou retirée d’une substance pour produire un changement de phase. Cette énergie décompose les forces d’attraction intermoléculaires, et doit également fournir l’énergie nécessaire à l’expansion du gaz (le travail pΔV). Lorsque de la chaleur latente est ajoutée, aucun changement de température ne se produit. L’enthalpie de vaporisation est fonction de la pression à laquelle cette transformation a lieu.
Chaleur latente de vaporisation – eau à 0,1 MPa (pression atmosphérique)
h lg = 2257 kJ / kg
Chaleur latente de vaporisation – eau à 3 MPa (pression à l’intérieur d’un générateur de vapeur)
h lg = 1795 kJ / kg
Chaleur latente de vaporisation – eau à 16 MPa (pression à l’intérieur d’un pressuriseur )
h lg = 931 kJ / kg
La chaleur de vaporisation diminue avec l’augmentation de la pression, tandis que le point d’ébullition augmente. Elle disparaît complètement à un certain point appelé le point critique . Au-dessus du point critique, les phases liquide et vapeur sont indiscernables et la substance est appelée fluide supercritique .
La chaleur de vaporisation est la chaleur nécessaire pour vaporiser complètement une unité de liquide saturé (ou condenser une unité de masse de vapeur saturée) et elle est égale à h lg = h g – h l .
La chaleur nécessaire pour faire fondre (ou geler) une masse unitaire à la substance à pression constante est la chaleur de fusion et est égale à h sl = h l – h s , où h s est l’enthalpie du solide saturé et h l est l’enthalpie du liquide saturé.
Enthalpie spécifique de vapeur humide
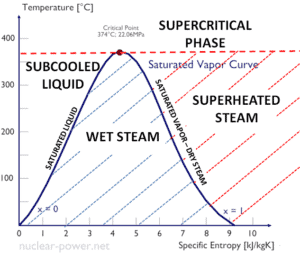 L’ enthalpie spécifique de l’eau liquide saturée (x = 0) et de la vapeur sèche (x = 1) peut être choisie dans les tables de vapeur. En cas de vapeur humide , l’enthalpie réelle peut être calculée avec la qualité de la vapeur, x , et les enthalpies spécifiques de l’eau liquide saturée et de la vapeur sèche:
L’ enthalpie spécifique de l’eau liquide saturée (x = 0) et de la vapeur sèche (x = 1) peut être choisie dans les tables de vapeur. En cas de vapeur humide , l’enthalpie réelle peut être calculée avec la qualité de la vapeur, x , et les enthalpies spécifiques de l’eau liquide saturée et de la vapeur sèche:
h humide = h s x + (1 – x) h l
où
h humide = enthalpie de vapeur humide (J / kg)
h s = enthalpie de vapeur «sèche» (J / kg)
h l = enthalpie de l’eau liquide saturée (J / kg)
Comme on peut le voir, la vapeur humide aura toujours une enthalpie plus faible que la vapeur sèche.
Exemple:
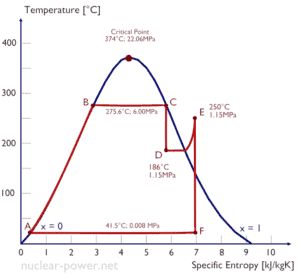
Un étage haute pression de turbine à vapeur fonctionne à l’état stable avec des conditions d’entrée de 6 MPa, t = 275,6 ° C, x = 1 (point C). La vapeur sort de cet étage de turbine à une pression de 1,15 MPa, 186 ° C et x = 0,87 (point D). Calculez la différence d’enthalpie entre ces deux états.
L’enthalpie pour l’état C peut être prélevée directement dans les tables de vapeur, tandis que l’enthalpie pour l’état D doit être calculée en utilisant la qualité de la vapeur:
h 1, humide = 2785 kJ / kg
h 2, humide = h 2, s x + (1 – x) h 2, l = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci