Gesetze der Thermodynamik
Es gibt vier Hauptsätze der Thermodynamik , die grundlegende physikalische Größen (Temperatur, Energie und Entropie) definieren und die thermodynamischen Systeme im thermischen Gleichgewicht charakterisieren . Diese gelten als eines der wichtigsten Gesetze der gesamten Physik. Die Gesetze sind wie folgt:
Zeroth-Gesetz der Thermodynamik:
Befinden sich zwei Systeme mit einem dritten im thermischen Gleichgewicht, befinden sie sich im thermischen Gleichgewicht.
Dieses Gesetz liefert eine Definition und Methode zur Definition von Temperaturen, die möglicherweise die wichtigste intensive Eigenschaft eines Systems bei der Behandlung von Problemen mit der Umwandlung von Wärmeenergie sind.
Erster Hauptsatz der Thermodynamik:
Die Zunahme der inneren Energie eines geschlossenen Systems entspricht der dem System zugeführten Wärme abzüglich der von ihm geleisteten Arbeit.
Dieses Gesetz ist das Prinzip der Energieeinsparung . Es ist das wichtigste Gesetz für die Analyse der meisten Systeme und die, die wie Wärmeenergie quantifiziert wird umgewandelt in andere Energieformen . Perpetuum-Motion-Maschinen der ersten Art sind daher unmöglich.
Zweiter Hauptsatz der Thermodynamik:
Die Entropie eines isolierten Systems nimmt nie ab. In einem natürlichen thermodynamischen Prozess nimmt die Summe der Entropien der wechselwirkenden thermodynamischen Systeme zu.
Dieses Gesetz gibt die Unumkehrbarkeit der natürlichen Prozesse . Reversible Prozesse sind eine nützliche und bequeme theoretische Fiktion, kommen aber in der Natur nicht vor. Aus diesem Gesetz folgt, dass es unmöglich ist, eine Vorrichtung zu konstruieren, die in einem Zyklus arbeitet und deren einzige Wirkung die Übertragung von Wärme von einem kühleren Körper zu einem heißeren Körper ist. Perpetuum-Motion-Maschinen der zweiten Art sind daher unmöglich.
Dritter Hauptsatz der Thermodynamik:
Die Entropie eines Systems nähert sich einem konstanten Wert, wenn sich die Temperatur dem absoluten Nullpunkt nähert.
Basierend auf empirischen Beweisen besagt dieses Gesetz, dass die Entropie einer reinen kristallinen Substanz beim absoluten Nullpunkt der Temperatur 0 K Null ist und dass es mit keinem noch so idealisierten Verfahren möglich ist, die Temperatur eines Systems zu senken in einer endlichen Anzahl von Schritten auf den absoluten Nullpunkt. Dies ermöglicht es uns, einen Nullpunkt für die Wärmeenergie eines Körpers zu definieren.
Populäre Version der Gesetze der Thermodynamik
0. Sie müssen das Spiel spielen.
1. Du kannst nicht gewinnen; Sie können nur die Gewinnschwelle erreichen.
2. Sie können nur bei absolutem Nullpunkt die Gewinnschwelle erreichen.
3. Sie können den absoluten Nullpunkt nicht erreichen.
Arbeit und Wärme in der Thermodynamik
Wärme in der Thermodynamik
Siehe auch: Wärme in der Thermodynamik
Siehe auch: Arbeiten in der Thermodynamik
Während sich innere Energie auf die Gesamtenergie aller Moleküle im Objekt bezieht, ist Wärme die Energiemenge, die aufgrund ihres Temperaturunterschieds spontan von einem Körper zum anderen fließt . Wärme ist eine Energieform, aber es ist Energie auf dem Transportweg . Wärme ist keine Eigenschaft eines Systems. Die Energieübertragung als Wärme erfolgt jedoch auf molekularer Ebene infolge eines Temperaturunterschieds .
Stellen Sie sich einen Metallblock mit hoher Temperatur vor, der aus Atomen besteht, die stark um ihre Durchschnittspositionen schwingen. Bei niedrigen Temperaturen schwingen die Atome weiter, jedoch mit geringerer Intensität . Wenn ein heißerer Metallblock mit einem kühleren Block in Kontakt gebracht wird, geben die stark oszillierenden Atome am Rand des heißeren Blocks ihre kinetische Energie an die weniger oszillierenden Atome am Rand des kühlen Blocks ab. In diesem Fall findet eine Energieübertragung zwischen diesen beiden Blöcken statt und durch diese zufälligen Vibrationen fließt Wärme vom heißeren zum kühleren Block.
Wenn zwei Objekte in thermischen Kontakt gebracht werden , fließt im Allgemeinen Wärme zwischen ihnen, bis sie sich im Gleichgewicht befinden . Wenn ein Temperaturunterschied besteht, fließt die Wärme spontan vom wärmeren System zum kälteren System . Die Wärmeübertragung erfolgt durch Wärmeleitung oder durch Wärmestrahlung . Wenn der Wärmefluss stoppt , haben sie angeblich die gleiche Temperatur . Sie sollen sich dann im thermischen Gleichgewicht befinden .
Wie bei der Arbeit hängt die übertragene Wärmemenge vom Pfad ab und nicht nur von den Anfangs- und Endbedingungen des Systems. Es gibt tatsächlich viele Möglichkeiten, das Gas von Zustand i zu Zustand f zu bringen.
Ebenso wie bei der Arbeit ist es wichtig, zwischen Wärme , die einem System von seiner Umgebung zugeführt wird, und Wärme, die von einem System an seine Umgebung abgegeben wird, zu unterscheiden. Q ist positiv für die dem System zugeführte Wärme. Wenn also Wärme das System verlässt, ist Q negativ. Da W in der Gleichung die vom System geleistete Arbeit ist, ist W negativ und E int nimmt zu , wenn am System gearbeitet wird.
Das Symbol q wird manchmal verwendet, um die Wärme anzuzeigen, die einem System pro Masseneinheit hinzugefügt oder von diesem abgeführt wird . Dies entspricht der Gesamtwärme (Q), die hinzugefügt oder entfernt wird, geteilt durch die Masse (m).
Arbeit in der Thermodynamik
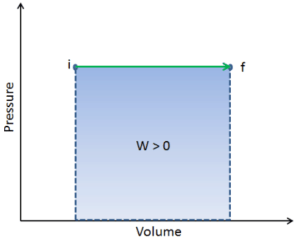
In der Thermodynamik ist die Arbeit eines Systems die Energie, die das System an seine Umgebung überträgt. Kinetische Energie, potentielle Energie und innere Energie sind Energieformen, die Eigenschaften eines Systems sind. Arbeit ist eine Form von Energie , aber es ist Energie auf der Durchreise . Ein System enthält keine Arbeit, Arbeit ist ein Prozess, der von oder auf einem System ausgeführt wird. Im Allgemeinen wird Arbeit für mechanische Systeme als die Wirkung einer Kraft auf ein Objekt über eine Distanz definiert.
W = F. d
wo:
W = Arbeit (J)
F = Kraft (N)
d = Verschiebung (m)
Wärmekraftmaschinen und thermischer Wirkungsgrad
Energiequellen haben immer eine sehr wichtige Rolle bei der Entwicklung der menschlichen Gesellschaft gespielt. Energie ist im Allgemeinen definiert als das Potenzial, Arbeit zu leisten oder Wärme zu erzeugen . Manchmal ist es wie die „Währung“ für die Ausführung von Arbeiten. Eine der wunderbarsten Eigenschaften des Universums ist, dass Energie von einem Typ in einen anderen umgewandelt und von einem Objekt auf ein anderes übertragen werden kann .
Im Allgemeinen ist es einfach, Wärmeenergie durch Arbeiten zu erzeugen , beispielsweise durch einen beliebigen Reibungsprozess. Es ist jedoch schwieriger , Arbeit mit Wärmeenergie zu bekommen . Es ist eng mit dem Konzept der Entropie verbunden . Zum Beispiel ist Elektrizität besonders nützlich, da sie eine sehr niedrige Entropie aufweist (hochgeordnet ist) und sehr effizient in andere Energieformen umgewandelt werden kann .
Manchmal steht mechanische Energie direkt zur Verfügung, zum Beispiel Windkraft und Wasserkraft. Der größte Teil unserer Energie stammt jedoch aus der Verbrennung fossiler Brennstoffe (Kohle, Öl und Gas) und aus Kernreaktionen . Derzeit sind fossile Brennstoffe immer noch die weltweit vorherrschende Energiequelle. Die Verbrennung fossiler Brennstoffe erzeugt jedoch nur Wärmeenergie . Daher werden diese Energiequellen als „ Primärenergiequellen “ bezeichnet, die in sekundäre Energiequellen umgewandelt werden müssen , sogenannte Energieträger ( elektrische Energie usw.). Um Wärmeenergie in eine andere Energieform umzuwandeln, eine Wärmekraftmaschine muss benutzt werden.
Im Allgemeinen ist eine Wärmekraftmaschine eine Vorrichtung, die chemische Energie in Wärme oder Wärmeenergie und dann in mechanische Energie oder in elektrische Energie umwandelt. Viele Wärmekraftmaschinen arbeiten zyklisch, indem sie in einem Teil des Zyklus Energie in Form von Wärme hinzufügen und diese Energie verwenden, um in einem anderen Teil des Zyklus nützliche Arbeit zu leisten.
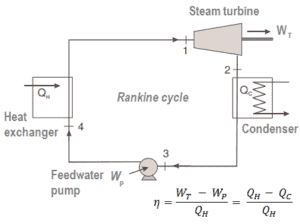
Wie in allen herkömmlichen Wärmekraftwerken üblich, wird die Wärme beispielsweise zur Erzeugung von Dampf verwendet, der eine Dampfturbine antreibt, die mit einem Generator verbunden ist, der Strom erzeugt. Dampferzeuger , Dampfturbinen, Kondensatoren und Speisewasserpumpen bilden eine Wärmekraftmaschine , die den durch den zweiten Hauptsatz der Thermodynamik auferlegten Wirkungsgradbeschränkungen unterliegt . In modernen Kernkraftwerken beträgt der thermodynamische Gesamtwirkungsgrad etwa ein Drittel (33%), sodass 3000 MWth Wärmeleistung aus der Spaltreaktion benötigt werden, um 1000 MWe elektrischen Strom zu erzeugen .
Siehe auch: Wärmekraftmaschinen
Thermischen Wirkungsgrad
Wir definieren den thermischen Wirkungsgrad , η th , einen Wärmekraftmaschine als das Verhältnis der Arbeits es tut, W , an den Wärmeeingang bei der hohen Temperatur, Q H .
Der thermische Wirkungsgrad , η th , stellt den Anteil an Wärme , Q H , die konvertiert wird , zu arbeiten . Es ist ein dimensionsloses Leistungsmaß für eine Wärmekraftmaschine, die Wärmeenergie verwendet, z. B. eine Dampfturbine, eine Verbrennungsmaschine oder einen Kühlschrank. Bei einer Kälte- oder Wärmepumpe gibt der thermische Wirkungsgrad an, inwieweit die durch Arbeit hinzugefügte Energie in Nettowärmeleistung umgewandelt wird. Da es sich um eine dimensionslose Zahl handelt, müssen wir W, Q H und Q C immer in denselben Einheiten ausdrücken .
Da Energie nach dem ersten Hauptsatz der Thermodynamik eingespart wird und Energie nicht vollständig in Arbeit umgewandelt werden kann , muss der Wärmeeintrag Q H gleich der geleisteten Arbeit W plus der Wärme sein, die als Abwärme Q C an die abgegeben werden muss Umgebung. Daher können wir die Formel für den thermischen Wirkungsgrad wie folgt umschreiben:
Um den Wirkungsgrad in Prozent anzugeben, multiplizieren wir die vorherige Formel mit 100. Beachten Sie, dass η th nur dann 100% sein kann, wenn die Abwärme Q C Null ist.
Im Allgemeinen ist der Wirkungsgrad selbst der besten Wärmekraftmaschinen recht gering. Kurz gesagt, es ist sehr schwierig , Wärmeenergie in mechanische Energie umzuwandeln . Die thermischen Wirkungsgrade liegen üblicherweise unter 50% und oft weit darunter. Seien Sie vorsichtig, wenn Sie es mit den Wirkungsgraden von Wind- oder Wasserkraft vergleichen (Windkraftanlagen sind keine Wärmekraftmaschinen). Es gibt keine Energieumwandlung zwischen thermischer und mechanischer Energie.
Siehe auch: Carnots Prinzip
Siehe auch: Thermische Effizienz
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.


