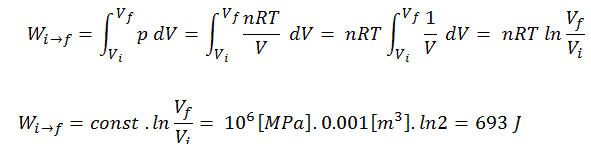Exemple de processus isothermique
Supposons une expansion isotherme de l’hélium (i → f) dans un piston sans friction (système fermé). L’expansion des gaz est propulsée par absorption de l’énergie thermique Q add . Le gaz se dilate à partir du volume initial de 0,001 m 3 et simultanément la charge externe du piston diminue lentement et de façon continue de 1 MPa à 0,5 MPa. Comme l’hélium se comporte presque comme un gaz parfait, utilisez la loi des gaz parfaits pour calculer le volume final de la chambre, puis le travail effectué par le système lorsque la température du gaz est égale à 400 K.
Solution:
Le volume final du gaz, V f , peut être calculé en utilisant p, V, T Relation pour le processus isothermique:
P i V i = p f V f ⇒ V f = p i V i / p f = 2 x 0,001 m 3 = 0,002 m 3
Pour calculer de tels processus, nous aurions besoin de savoir comment la pression varie en fonction du volume du processus réel selon lequel le système passe de l’état i à l’état f . Comme pendant ce processus la pression interne n’était pas constante, le travail pV effectué par le piston doit être calculé en utilisant l’intégrale suivante:
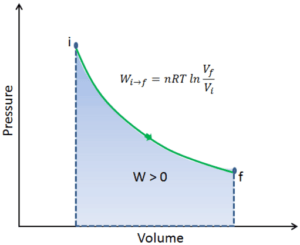
Par convention, une valeur positive pour le travail indique que le système effectue le travail sur son environnement. Une valeur négative indique que le travail est effectué sur le système en fonction de son environnement. Le travail pΔV est égal à l’aire sous la courbe de processus tracée sur le diagramme pression-volume.
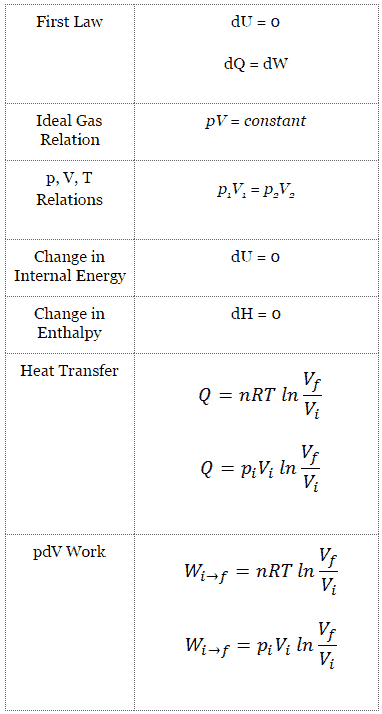

……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci