Lois de la thermodynamique
Il y a quatre lois de la thermodynamique qui définissent des grandeurs physiques fondamentales (température, énergie et entropie) et qui caractérisent les systèmes thermodynamiques à l’ équilibre thermique . Celles-ci sont considérées comme l’une des lois les plus importantes de la physique. Les lois sont les suivantes:
Loi de Zéroth de la thermodynamique:
Si deux systèmes sont tous deux en équilibre thermique avec un troisième, ils sont en équilibre thermique l’un avec l’autre.
Cette loi fournit une définition et une méthode de définition de la température, peut-être la propriété intensive la plus importante d’un système face à des problèmes de conversion d’énergie thermique.
Première loi de la thermodynamique:
L’augmentation de l’énergie interne d’un système fermé est égale à la chaleur fournie au système moins le travail effectué.
Cette loi est le principe de la conservation de l’énergie . C’est la loi la plus importante pour l’analyse de la plupart des systèmes et celle qui quantifie la transformation de l’ énergie thermique en d’autres formes d’énergie . Il s’ensuit que les machines à mouvement perpétuel du premier type sont impossibles.
Deuxième loi de la thermodynamique:
L’entropie de tout système isolé ne diminue jamais. Dans un processus thermodynamique naturel, la somme des entropies des systèmes thermodynamiques en interaction augmente.
Cette loi indique l’ irréversibilité des processus naturels . Les processus réversibles sont une fiction théorique utile et pratique, mais ne se produisent pas dans la nature. Il découle de cette loi qu’il est impossible de construire un dispositif qui fonctionne sur un cycle et dont le seul effet est le transfert de chaleur d’un corps plus froid à un corps plus chaud. Il s’ensuit que les machines à mouvement perpétuel du second type sont impossibles.
Troisième loi de la thermodynamique:
L’entropie d’un système se rapproche d’une valeur constante lorsque la température approche du zéro absolu.
Basée sur des preuves empiriques, cette loi stipule que l’ entropie d’une substance cristalline pure est nulle au zéro absolu de la température , 0 K et qu’il est impossible, par quelque procédé que ce soit, idéalisé, de réduire la température d’un système au zéro absolu en un nombre fini d’étapes. Cela nous permet de définir un point zéro pour l’énergie thermique d’un corps.
Version populaire des lois de la thermodynamique
0. Vous devez jouer au jeu.
1. Vous ne pouvez pas gagner; vous pouvez seulement atteindre le seuil de rentabilité.
2. Vous ne pouvez atteindre le point d’équilibre qu’au zéro absolu.
3. Vous ne pouvez pas atteindre le zéro absolu.
Travail et chaleur en thermodynamique
La chaleur en thermodynamique
Voir aussi: La chaleur en thermodynamique
Voir aussi: Travail en thermodynamique
Alors que l’énergie interne fait référence à l’énergie totale de toutes les molécules à l’intérieur de l’objet, la chaleur est la quantité d’énergie circulant d’un corps à un autre spontanément en raison de leur différence de température. La chaleur est une forme d’énergie, mais c’est de l’ énergie en transit . La chaleur n’est pas la propriété d’un système. Cependant, le transfert d’énergie sous forme de chaleur se produit au niveau moléculaire en raison d’une différence de température .
Considérons un bloc de métal à haute température, composé d’atomes qui oscillent intensément autour de leur position moyenne. Aux basses températures , les atomes continuent d’osciller, mais avec moins d’intensité . Si un bloc de métal plus chaud est mis en contact avec un bloc plus froid, les atomes oscillant intensément au bord du bloc plus chaud dégagent son énergie cinétique aux atomes moins oscillants au bord du bloc froid. Dans ce cas, il y a un transfert d’énergie entre ces deux blocs et des flux de chaleur du bloc le plus chaud vers le bloc le plus froid par ces vibrations aléatoires.
En général, lorsque deux objets sont mis en contact thermique , la chaleur circule entre eux jusqu’à ce qu’ils s’équilibrent . Lorsqu’il existe une différence de température , la chaleur circule spontanément du système le plus chaud vers le système le plus froid . Le transfert de chaleur se produit par conduction ou par rayonnement thermique . Lorsque le flux de chaleur s’arrête , on dit qu’ils sont à la même température . On dit alors qu’ils sont en équilibre thermique .
Comme pour le travail, la quantité de chaleur transférée dépend du chemin et non pas simplement des conditions initiales et finales du système. Il existe en fait plusieurs façons de transporter le gaz de l’état i à l’état f.
De même, comme pour le travail, il est important de faire la distinction entre la chaleur ajoutée à un système de son environnement et la chaleur retirée d’un système à son environnement. Q est positif pour la chaleur ajoutée au système, donc si la chaleur quitte le système, Q est négatif. Parce que W dans l’équation est le travail effectué par le système, alors si le travail est effectué sur le système, W sera négatif et E int augmentera.
Le symbole q est parfois utilisé pour indiquer la chaleur ajoutée ou retirée d’un système par unité de masse . Il est égal à la chaleur totale (Q) ajoutée ou retirée divisée par la masse (m).
Travail en thermodynamique
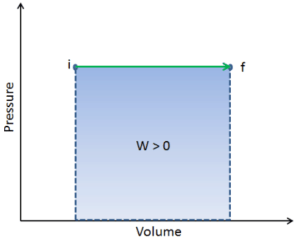
En thermodynamique, le travail effectué par un système est l’énergie transférée par le système à son environnement. L’énergie cinétique, l’énergie potentielle et l’énergie interne sont des formes d’énergie qui sont les propriétés d’un système. Le travail est une forme d’énergie , mais c’est de l’ énergie en transit . Un système ne contient aucun travail, le travail est un processus effectué par ou sur un système. En général, le travail est défini pour les systèmes mécaniques comme l’action d’une force sur un objet à travers une distance.
W = F. ré
où:
W = travail (J)
F = force (N)
d = déplacement (m)
Moteurs thermiques et efficacité thermique
Les sources d’énergie ont toujours joué un rôle très important dans le développement de la société humaine. L’énergie est généralement définie comme le potentiel de travail ou de production de chaleur . Parfois, c’est comme la «monnaie» pour effectuer un travail. L’une des propriétés les plus merveilleuses de l’univers est que l’ énergie peut être transformée d’un type à un autre et transférée d’un objet à un autre .
En général, il est facile de produire de l’énergie thermique en effectuant des travaux , par exemple par n’importe quel processus de friction. Mais obtenir du travail à partir de l’énergie thermique est plus difficile . Elle est étroitement associée au concept d’entropie . Par exemple, l’électricité est particulièrement utile car elle a une entropie très faible (est fortement ordonnée) et peut être convertie en d’autres formes d’énergie très efficacement .
Parfois, l’énergie mécanique est directement disponible, par exemple l’énergie éolienne et l’hydroélectricité. Mais la majeure partie de notre énergie provient de la combustion de combustibles fossiles (charbon, pétrole et gaz) et de réactions nucléaires . À l’heure actuelle, les combustibles fossiles sont toujours la principale source d’énergie au monde. Mais la combustion de combustibles fossiles ne génère que de l’énergie thermique , donc ces sources d’énergie sont appelées « sources d’énergie primaire », qui doivent être converties en source d’énergie secondaire , appelées vecteurs d’énergie ( énergie électrique, etc.). Pour convertir l’énergie thermique en une autre forme d’énergie, un moteur thermique doit être utilisé.
En général, un moteur thermique est un appareil qui convertit l’énergie chimique en chaleur ou en énergie thermique, puis en énergie mécanique ou en énergie électrique. De nombreux moteurs thermiques fonctionnent de manière cyclique, ajoutant de l’énergie sous forme de chaleur dans une partie du cycle et utilisant cette énergie pour effectuer un travail utile dans une autre partie du cycle.
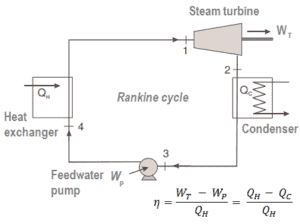
Par exemple, comme c’est typique dans toutes les centrales thermiques conventionnelles , la chaleur est utilisée pour générer de la vapeur qui entraîne une turbine à vapeur connectée à un générateur qui produit de l’électricité. Les générateurs de vapeur, les turbines à vapeur, les condenseurs et les pompes à eau d’alimentation constituent un moteur thermique soumis aux limitations d’efficacité imposées par la deuxième loi de la thermodynamique . Dans les centrales nucléaires modernes , l’efficacité thermodynamique globale est d’environ un tiers (33%), de sorte que 3000 MWth d’énergie thermique provenant de la réaction de fission sont nécessaires pour générer 1000 MWe d’énergie électrique.
Voir aussi: Moteurs thermiques
Efficacité thermique
On définit le rendement thermique , η e , d’un moteur thermique en tant que rapport du travail qu’il fait, W , à la chaleur d’ entrée à la température élevée, Q H .
L’ efficacité thermique , η th , représente la fraction de chaleur , Q H , qui est convertie en travail . Il s’agit d’une mesure de performance sans dimension d’un moteur thermique qui utilise l’énergie thermique, comme une turbine à vapeur, un moteur à combustion interne ou un réfrigérateur. Pour une réfrigération ou des pompes à chaleur, l’efficacité thermique indique dans quelle mesure l’énergie ajoutée par le travail est convertie en chaleur nette. Puisqu’il s’agit d’un nombre sans dimension, nous devons toujours exprimer W, Q H et Q C dans les mêmes unités.
Étant donné que l’énergie est conservée selon la première loi de la thermodynamique et que l’énergie ne peut pas être convertie pour fonctionner complètement, l’apport de chaleur, Q H , doit être égal au travail effectué, W, plus la chaleur qui doit être dissipée sous forme de chaleur résiduelle Q C dans le environnement. Par conséquent, nous pouvons réécrire la formule de l’efficacité thermique comme suit:
Pour donner l’efficacité en pourcentage, nous multiplions la formule précédente par 100. Notez que, η th pourrait être de 100% seulement si la chaleur perdue Q C sera nulle.
En général, l’efficacité même des meilleurs moteurs thermiques est assez faible. Bref, il est très difficile de convertir l’ énergie thermique à énergie mécanique . Les rendements thermiques sont généralement inférieurs à 50% et souvent très inférieurs. Soyez prudent lorsque vous le comparez aux rendements de l’énergie éolienne ou hydraulique (les éoliennes ne sont pas des moteurs thermiques), il n’y a pas de conversion d’énergie entre l’énergie thermique et mécanique.
Voir aussi: Principe de Carnot
Voir aussi: Efficacité thermique
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci


