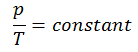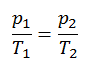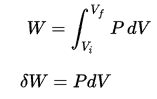Processo Isocórico – Processo Isométrico
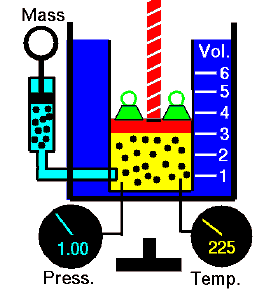
Um processo isocórico é um processo termodinâmico, no qual o volume do sistema fechado permanece constante (V = const). Ele descreve o comportamento do gás dentro do recipiente, que não pode ser deformado. Como o volume permanece constante, a transferência de calor para dentro ou para fora do sistema não funciona , mas altera apenas a energia interna (a temperatura) do sistema.
Para um gás ideal e um processo politrópico , o caso n ➝ ∞ corresponde a um processo isocórico (volume constante) . Ao contrário do processo adiabático , em que n = e um sistema não troca calor com o ambiente (Q = 0; W ≠ 0 ) , em um processo isocórico ocorre uma mudança na energia interna (devido a ∆T ≠ 0) e portanto ΔU ≠ 0 (para gases ideais) e (Q ≠ 0; W = 0 ).
Na engenharia de motores de combustão interna , os processos isocóricos são muito importantes para seus ciclos termodinâmicos (ciclo Otto e Diesel), portanto, o estudo desse processo é crucial para a engenharia automotiva.
Processo isocórico e a primeira lei
A forma clássica da primeira lei da termodinâmica é a seguinte equação:
dU = dQ – dW
Nesta equação, dW é igual a dW = pdV e é conhecido como trabalho de fronteira . Então:
dU = dQ – pdV
No processo isocórico e no gás ideal, todo o calor adicionado ao sistema será usado para aumentar a energia interna.
Processo isocórico (pdV = 0):
dU = dQ (para gás ideal)
Processo Isocórico – Equação Ideal de Gás
Veja também: O que é um gás ideal
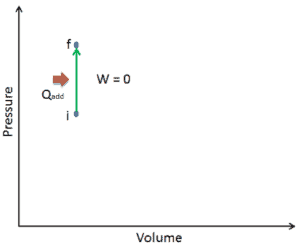 Vamos assumir uma adição de calor isocórico em um gás ideal. Num gás ideal , as moléculas não têm volume e não interagem. De acordo com a lei ideal dos gases , a pressão varia linearmente com a temperatura e a quantidade e inversamente com o volume .
Vamos assumir uma adição de calor isocórico em um gás ideal. Num gás ideal , as moléculas não têm volume e não interagem. De acordo com a lei ideal dos gases , a pressão varia linearmente com a temperatura e a quantidade e inversamente com o volume .
pV = nRT
Onde:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
O processo isocórico pode ser expresso com a lei dos gases ideais como:
ou
Em um diagrama pV , o processo ocorre ao longo de uma linha horizontal que possui a equação V = constante.
O trabalho de volume de pressão pelo sistema fechado é definido como:
Como o processo é isocórico , dV = 0 , o trabalho pressão-volume é igual a zero . De acordo com o modelo de gás ideal, a energia interna pode ser calculada por:
∆U = mc v ∆T
onde a propriedade c v (J / mol K) é referida como calor específico (ou capacidade de calor ) a um volume constante porque, sob certas condições especiais (volume constante), relaciona a mudança de temperatura de um sistema à quantidade de energia adicionada por transferência de calor.
Como não há trabalho realizado pelo ou no sistema, a primeira lei da termodinâmica determina ∆U = ∆Q. Portanto:
Q = mc v ∆T
Veja também: Calor específico a volume constante e pressão constante
Veja também: Fórmula de Mayer
Lei de Guy-Lussac
A lei de Guy-Lussac ou a lei de pressão, uma das leis de gás, afirma que:
Para uma massa fixa de gás em volume constante, a pressão é diretamente proporcional à temperatura Kelvin.
Isso significa que, por exemplo, se você dobrar a temperatura, dobrará a pressão. Se você reduzir pela metade a temperatura, reduzirá a pressão pela metade.
Você pode expressar isso matematicamente como:
p = constante. T
Sim, parece ser idêntico ao processo isocórico do gás ideal. Esses resultados são totalmente consistentes com a lei ideal dos gases, que determina que a constante é igual a nR / V. Se você reorganizar a equação pV = nRT dividindo os dois lados por V, obterá:
p = nR / V. T
onde nR / V é constante e:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro
Exemplo de processo isocórico – adição de calor isocórico
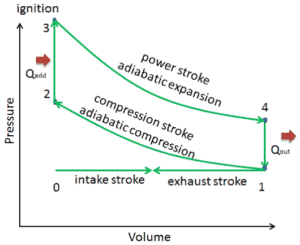 Vamos assumir o ciclo Otto , que é um dos ciclos termodinâmicos mais comuns encontrados em motores de automóveis . Este ciclo pressupõe que a adição de calor ocorra instantaneamente ( entre 2 → 3 ) enquanto o pistão está no ponto morto superior. Esse processo é considerado isocórico.
Vamos assumir o ciclo Otto , que é um dos ciclos termodinâmicos mais comuns encontrados em motores de automóveis . Este ciclo pressupõe que a adição de calor ocorra instantaneamente ( entre 2 → 3 ) enquanto o pistão está no ponto morto superior. Esse processo é considerado isocórico.
Os processos 2 → 3 e 4 → 1 são processos isocóricos , nos quais o calor é transferido para o sistema entre 2 → 3 e para fora do sistema entre 4 → 1. Durante esses processos, nenhum trabalho é realizado no sistema ou extraído do sistema . O processo isocórico 2 → 3 destina-se a representar a ignição da mistura combustível-ar e a subsequente queima rápida.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.