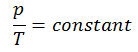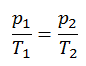Carnot-Zyklus – pV, Ts-Diagramm
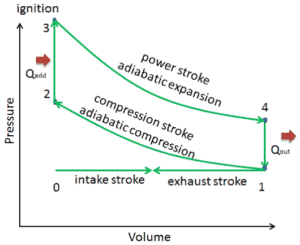
Der Otto-Zyklus wird häufig in einem Druck-Volumen-Diagramm ( pV-Diagramm ) und in einem Temperatur-Entropie-Diagramm (Ts-Diagramm) dargestellt. In einem Druckvolumendiagramm folgen die isochoren Prozesse den isochoren Linien für das Gas (den vertikalen Linien), zwischen diesen vertikalen Linien bewegen sich adiabatische Prozesse , und der durch den vollständigen Zyklusweg begrenzte Bereich repräsentiert die Gesamtarbeit, die während eines Gases geleistet werden kann Zyklus.
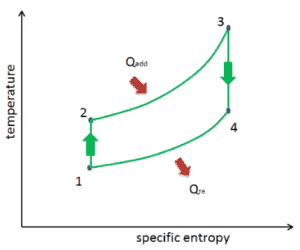
Das Temperatur-Entropie-Diagramm ( Ts-Diagramm ), bei dem der thermodynamische Zustand durch einen Punkt auf einem Diagramm mit spezifischer Entropie (s) als horizontaler Achse und absoluter Temperatur (T) als vertikaler Achse angegeben wird. Ts-Diagramme sind ein nützliches und gebräuchliches Werkzeug, insbesondere weil sie dabei helfen, den Wärmeübergang während eines Prozesses zu visualisieren. Bei reversiblen (idealen) Prozessen ist die Fläche unter der Ts-Kurve eines Prozesses die Wärme, die während dieses Prozesses an das System übertragen wird.
Isentroper Prozess
Ein isentroper Prozess ist ein thermodynamischer Prozess , bei dem die Entropie des Fluids oder Gases konstant bleibt. Dies bedeutet, dass der isentrope Prozess ein Sonderfall eines adiabatischen Prozesses ist, bei dem keine Wärme- oder Stoffübertragung stattfindet. Es handelt sich um einen reversiblen adiabatischen Prozess . Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Näherung nur bei sehr schnellen Prozessen anwenden können .
Isentroper Prozess und der erste Hauptsatz
Für ein geschlossenes System können wir den ersten Hauptsatz der Thermodynamik in Bezug auf die Enthalpie schreiben :
dH = dQ + Vdp
oder
dH = TdS + Vdp
Isentroper Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (für ideales Gas )
Isentroper Prozess des idealen Gases
Der isentrope Prozess (ein Sonderfall des adiabatischen Prozesses) lässt sich mit dem idealen Gasgesetz wie folgt ausdrücken :
pV κ = konstant
oder
p 1 V 1 κ = p 2 V 2 κ
wobei κ = c p /c v das Verhältnis der spezifischen Wärmen (oder Wärmekapazitäten ) für das Gas ist. Eine für konstanten Druck (c p ) und eine für konstantes Volumen (c v ) . Beachten Sie, dass dieses Verhältnis κ = c p /c v ein Faktor bei der Bestimmung der Schallgeschwindigkeit in einem Gas und anderen adiabatischen Prozessen ist.
Isothermer Prozess
Ein isochorer Prozess ist ein thermodynamischer Prozess, bei dem das Volumen des geschlossenen Systems konstant bleibt (V = const). Es beschreibt das Verhalten von Gas im Inneren des Behälters, das nicht verformt werden kann. Da das Volumen konstant bleibt, bewirkt der Wärmetransport in das oder aus dem System nicht die p∆V-Arbeit , sondern ändert nur die innere Energie (die Temperatur) des Systems.
Isochorer Prozess und erster Hauptsatz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit . Dann:
dU = dQ – pdV
Beim isochoren Prozess und dem idealen Gas wird die gesamte dem System zugeführte Wärme verwendet, um die innere Energie zu erhöhen.
Isochorer Prozess (pdV = 0):
dU = dQ (für ideales Gas)
dU = 0 = Q – W → W = Q (für ideales Gas)
Isochorer Prozess des idealen Gases
Der isochore Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
oder
In einem pV-Diagramm erfolgt der Prozess entlang einer horizontalen Linie mit der Gleichung V = konstant.
Siehe auch: Gesetz von Guy-Lussac
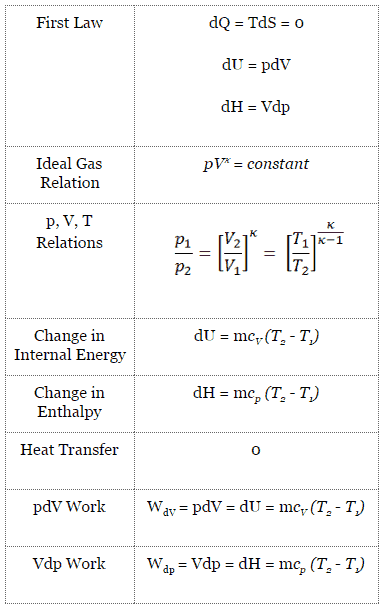

Vergleich von tatsächlichen und idealen Otto-Zyklen
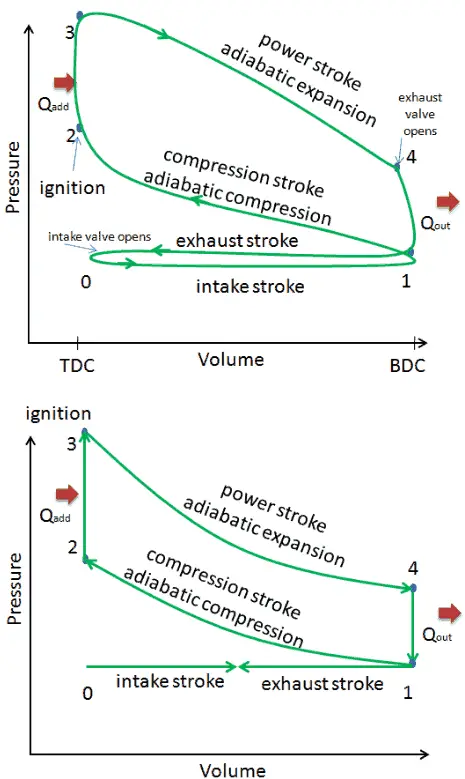 In diesem Abschnitt wird ein idealer Otto-Zyklus gezeigt, bei dem viele Annahmen vom tatsächlichen Otto-Zyklus abweichen . Die Hauptunterschiede zwischen dem tatsächlichen und dem idealen Ottomotor sind in der Abbildung zu sehen. In Wirklichkeit tritt der ideale Zyklus nicht auf und mit jedem Prozess sind viele Verluste verbunden. Für einen tatsächlichen Zyklus ist die Form des pV-Diagramms dem Ideal ähnlich, aber die vom pV-Diagramm eingeschlossene Fläche (Arbeit) ist immer kleiner als der Idealwert. Der ideale Otto-Zyklus basiert auf folgenden Annahmen:
In diesem Abschnitt wird ein idealer Otto-Zyklus gezeigt, bei dem viele Annahmen vom tatsächlichen Otto-Zyklus abweichen . Die Hauptunterschiede zwischen dem tatsächlichen und dem idealen Ottomotor sind in der Abbildung zu sehen. In Wirklichkeit tritt der ideale Zyklus nicht auf und mit jedem Prozess sind viele Verluste verbunden. Für einen tatsächlichen Zyklus ist die Form des pV-Diagramms dem Ideal ähnlich, aber die vom pV-Diagramm eingeschlossene Fläche (Arbeit) ist immer kleiner als der Idealwert. Der ideale Otto-Zyklus basiert auf folgenden Annahmen:
- Geschlossener Kreislauf. Der größte Unterschied zwischen den beiden Diagrammen ist die Vereinfachung der Ein- und Auslasshübe im idealen Zyklus. Im Auspufftakt wird die Wärme Q out an die Umgebung abgegeben, in einem realen Motor verlässt das Gas den Motor und wird durch ein neues Luft-Kraftstoff-Gemisch ersetzt.
- Sofortige Wärmezufuhr (isochore Wärmezufuhr). Bei realen Motoren erfolgt die Wärmezufuhr nicht sofort, daher liegt der Spitzendruck nicht am OT, sondern kurz nach dem OT.
- Keine Wärmeübertragung (adiabatisch)
- Verdichtung – Das Gas (Kraftstoff-Luft-Gemisch) wird adiabatisch von Zustand 1 auf Zustand 2 verdichtet. In realen Motoren gibt es immer einige Ineffizienzen, die den thermischen Wirkungsgrad mindern.
- Erweiterung. Das Gas (Kraftstoff-Luft-Gemisch) expandiert adiabatisch vom Zustand 3 in den Zustand 4.
- Vollständige Verbrennung des Kraftstoff-Luft-Gemisches.
- Keine Pumparbeiten . Die Pumparbeit ist die Differenz zwischen der Arbeit, die während des Auspufftakts geleistet wird, und der Arbeit, die während des Ansaugtakts geleistet wird. In realen Zyklen besteht eine Druckdifferenz zwischen Abgas- und Einlassdruck.
- Kein Blowdown-Verlust . Der Abblaseverlust wird durch das frühe Öffnen der Auslassventile verursacht. Dies führt zu einem Verlust der Arbeitsleistung während des Expansionshubs.
- Kein Blow-by-Verlust . Der Blow-by-Verlust wird durch das Austreten von komprimierten Gasen durch Kolbenringe und andere Spalten verursacht.
- Keine Reibungsverluste .
Diese vereinfachenden Annahmen und Verluste führen dazu, dass die eingeschlossene Fläche (Arbeit) des pV-Diagramms für einen realen Motor deutlich kleiner ist als die Größe der vom pV-Diagramm des idealen Zyklus eingeschlossenen Fläche (Arbeit). Mit anderen Worten, der ideale Motorzyklus wird das Netz überschätzen und bei gleicher Drehzahl die Leistung des eigentlichen Motors um etwa 20 % erhöhen.