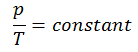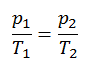Ciclo de Carnot – diagrama pV, Ts
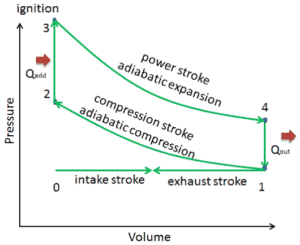
O ciclo Otto é frequentemente plotado em um diagrama pressão-volume ( diagrama pV ) e em um diagrama temperatura-entropia (diagrama Ts). Quando plotados em um diagrama de volume de pressão, os processos isocóricos seguem as linhas isocóricas do gás (as linhas verticais), os processos adiabáticos se movem entre essas linhas verticais e a área delimitada pelo caminho completo do ciclo representa o trabalho total que pode ser feito durante um ciclo.
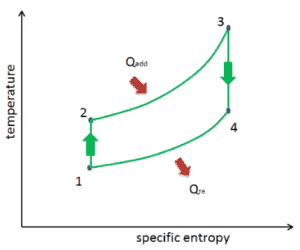
O diagrama de temperatura-entropia (diagrama Ts ) no qual o estado termodinâmico é especificado por um ponto em um gráfico com entropia (s) específica (s) como eixo horizontal e temperatura absoluta (T) como eixo vertical. Os diagramas Ts são uma ferramenta útil e comum, principalmente porque ajuda a visualizar a transferência de calor durante um processo. Para processos reversíveis (ideais), a área sob a curva Ts de um processo é o calor transferido para o sistema durante esse processo.
Processo isentrópico
Um processo isentrópico é um processo termodinâmico , no qual a entropia do fluido ou gás permanece constante. Isso significa que o processo isentrópico é um caso especial de um processo adiabático no qual não há transferência de calor ou matéria. É um processo adiabático reversível . A suposição de que não há transferência de calor é muito importante, pois podemos usar a aproximação adiabática apenas em processos muito rápidos .
Processo isentrópico e a primeira lei
Para um sistema fechado, podemos escrever a primeira lei da termodinâmica em termos de entalpia :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C P (T 2 – T 1 ) (para gás ideal )
Processo isentrópico do gás ideal
O processo isentrópico (um caso especial de processo adiabático) pode ser expresso com a lei dos gases ideais como:
pV κ = constante
ou
p 1 V 1 k = p 2 V 2 k
em que κ = c p / c v é a proporção de aquecimentos específicos (ou capacidades de calor ) para o gás. Um para pressão constante (c p ) e outro para volume constante (c v ) . Observe que essa razão κ = c p / c v é um fator na determinação da velocidade do som em um gás e em outros processos adiabáticos.
Processo isotérmico
Um processo isocórico é um processo termodinâmico, no qual o volume do sistema fechado permanece constante (V = const). Ele descreve o comportamento do gás dentro do recipiente, que não pode ser deformado. Como o volume permanece constante, a transferência de calor para dentro ou para fora do sistema não funciona , mas altera apenas a energia interna (a temperatura) do sistema.
Processo isocórico e a primeira lei
A forma clássica da primeira lei da termodinâmica é a seguinte equação:
dU = dQ – dW
Nesta equação, dW é igual a dW = pdV e é conhecido como trabalho de fronteira . Então:
dU = dQ – pdV
No processo isocórico e no gás ideal , todo o calor adicionado ao sistema será usado para aumentar a energia interna.
Processo isocórico (pdV = 0):
dU = dQ (para gás ideal)
dU = 0 = Q – W → W = Q (para gás ideal)
Processo isocórico do gás ideal
O processo isocórico pode ser expresso com a lei dos gases ideais como:
ou
Em um diagrama pV , o processo ocorre ao longo de uma linha horizontal que possui a equação V = constante.
Veja também: Lei de Guy-Lussac
Comparação dos ciclos Otto reais e ideais
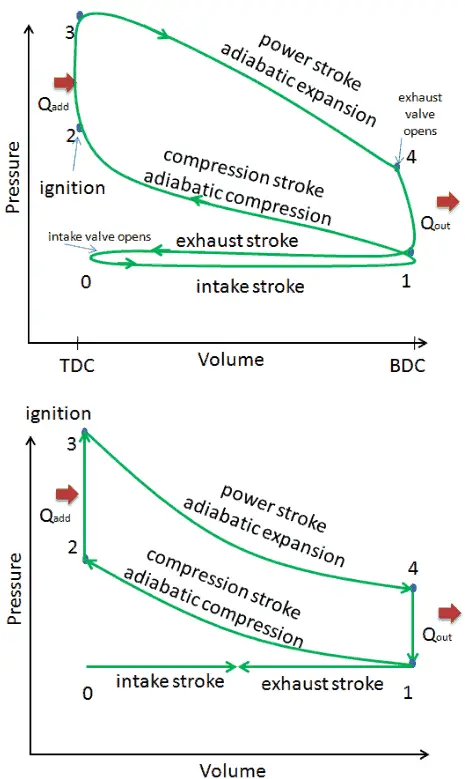 Nesta seção, é mostrado um ciclo Otto ideal, no qual existem muitas suposições diferentes do ciclo Otto real . As principais diferenças entre o mecanismo Otto real e ideal aparecem na figura. Na realidade, o ciclo ideal não ocorre e há muitas perdas associadas a cada processo. Para um ciclo real, a forma do diagrama de pV é semelhante ao ideal, mas a área (trabalho) delimitada pelo diagrama de pV é sempre menor que o valor ideal. O ciclo Otto ideal é baseado nas seguintes premissas:
Nesta seção, é mostrado um ciclo Otto ideal, no qual existem muitas suposições diferentes do ciclo Otto real . As principais diferenças entre o mecanismo Otto real e ideal aparecem na figura. Na realidade, o ciclo ideal não ocorre e há muitas perdas associadas a cada processo. Para um ciclo real, a forma do diagrama de pV é semelhante ao ideal, mas a área (trabalho) delimitada pelo diagrama de pV é sempre menor que o valor ideal. O ciclo Otto ideal é baseado nas seguintes premissas:
- Ciclo fechado. A maior diferença entre os dois diagramas é a simplificação dos movimentos de admissão e escape no ciclo ideal. No curso de escape, o calor Q out é ejetado para o ambiente, em um motor real, o gás sai do motor e é substituído por uma nova mistura de ar e combustível.
- Adição instantânea de calor ( adição isocórica de calor). Em motores reais, a adição de calor não é instantânea; portanto, o pico de pressão não está no TDC, mas logo após o TDC.
- Sem transferência de calor (adiabático)
- Compressão – O gás (mistura combustível-ar) é comprimido adiabaticamente do estado 1 ao estado 2. Nos motores reais, sempre existem algumas ineficiências que reduzem a eficiência térmica.
- Expansão. O gás (mistura combustível-ar) se expande adiabaticamente do estado 3 para o estado 4.
- Combustão completa da mistura combustível-ar.
- Nenhum trabalho de bombeamento . Trabalho de bombeamento é a diferença entre o trabalho realizado durante o golpe de escape e o trabalho realizado durante o golpe de admissão. Nos ciclos reais, há uma diferença de pressão entre as pressões de exaustão e de entrada.
- Sem perda de purga . A perda de purga é causada pela abertura precoce das válvulas de escape. Isso resulta em uma perda de produção durante o curso de expansão.
- Sem perda de impacto . A perda soprada é causada pelo vazamento de gases comprimidos através de anéis de pistão e outras fendas.
- Sem perdas por atrito .
Essas suposições e perdas simplificadoras levam ao fato de que a área fechada (trabalho) do diagrama de pV para um motor real é significativamente menor que o tamanho da área (trabalho) envolvida pelo diagrama de pV do ciclo ideal. Em outras palavras, o ciclo ideal do motor superestimará o trabalho líquido e, se os motores funcionarem na mesma velocidade, maior potência produzida pelo motor real em cerca de 20%.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.