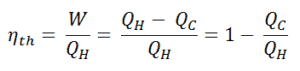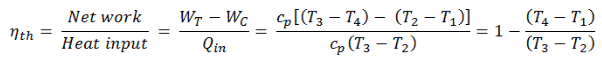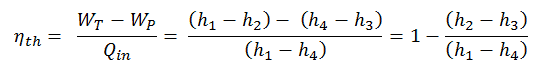Cálculo de eficiencia térmica
Como resultado de esta declaración, se define el rendimiento térmico , η º , de cualquier motor térmico como la relación entre el trabajo que hace, W , para el calor de entrada a la alta temperatura, Q H .
La eficiencia térmica , η th , representa la fracción de calor , Q H , que se convierte en trabajo . Es una medida de rendimiento sin dimensiones de un motor térmico que utiliza energía térmica, como una turbina de vapor, un motor de combustión interna o un refrigerador. Para una bomba de refrigeración o de calor, la eficiencia térmica indica el grado en que la energía agregada por el trabajo se convierte en salida neta de calor. Como es un número adimensional, siempre debemos expresar W, Q H y Q C en las mismas unidades.
Dado que la energía se conserva de acuerdo con la primera ley de la termodinámica y la energía no se puede convertir en trabajo por completo, la entrada de calor, Q H , debe ser igual al trabajo realizado, W, más el calor que se debe disipar como calor residual Q C en el ambiente. Por lo tanto, podemos reescribir la fórmula para la eficiencia térmica como:
Para dar la eficiencia como un porcentaje, multiplicamos la fórmula anterior por 100. Tenga en cuenta que, η th podría ser 100% solo si el calor residual Q C será cero.
En general, la eficiencia de incluso los mejores motores térmicos es bastante baja. En resumen, es muy difícil de convertir la energía térmica a la energía mecánica . Las eficiencias térmicas suelen ser inferiores al 50% y, a menudo, muy inferiores. Tenga cuidado cuando lo compara con la eficiencia de la energía eólica o hidráulica (las turbinas eólicas no son motores de calor), no hay conversión de energía entre la energía térmica y mecánica.
Cálculo del ciclo de Brayton
Supongamos el ciclo Brayton ideal que describe el funcionamiento de un motor de calor a presión constante . Los modernos motores de turbina de gas y los motores de inyección de aire también siguen el ciclo de Brayton. Este ciclo consta de cuatro procesos termodinámicos:
-

El ciclo ideal de Brayton consiste en cuatro procesos termodinámicos. Dos procesos isentrópicos y dos procesos isobáricos. Compresión isentrópica : el aire ambiente ingresa al compresor, donde se presuriza (1 → 2). El trabajo requerido para el compresor viene dado por W C = H 2 – H 1 .
- adición de calor isobárico : el aire comprimido pasa a través de una cámara de combustión, donde se quema el combustible y se calienta el aire u otro medio (2 → 3). Es un proceso de presión constante, ya que la cámara está abierta para fluir hacia adentro y hacia afuera. El calor neto agregado viene dado por Q add = H 3 – H 2
- Expansión isentrópica : el aire calentado y presurizado se expande en la turbina y entrega su energía. El trabajo realizado por la turbina viene dado por W T = H 4 – H 3
- rechazo de calor isobárico : el calor residual debe rechazarse para cerrar el ciclo. El calor neto rechazado viene dado por Q re = H 4 – H 1
Como se puede ver, podemos describir y calcular (por ejemplo, eficiencia termodinámica) tales ciclos (de manera similar para el ciclo de Rankine ) usando entalpías .
Para calcular la eficiencia térmica del ciclo Brayton (compresor simple y turbina simple), los ingenieros utilizan la primera ley de la termodinámica en términos de entalpía en lugar de en términos de energía interna.
La primera ley en términos de entalpía es:
dH = dQ + Vdp
En esta ecuación, el término Vdp es un proceso de flujo de trabajo. Este trabajo, Vdp , se utiliza para sistemas de flujo abierto como una turbina o una bomba en la que hay un “dp” , es decir, un cambio de presión. No hay cambios en el volumen de control . Como puede verse, esta forma de ley simplifica la descripción de la transferencia de energía .
Hay expresiones en términos de variables más familiares como temperatura y presión :
dH = C p dT + V (1-αT) dp
Donde C p es la capacidad calorífica a presión constante y α es el coeficiente de expansión térmica (cúbica). Para gas ideal αT = 1 y por lo tanto:
dH = C p dT
A presión constante , el cambio de entalpía es igual a la energía transferida del ambiente a través del calentamiento:
Proceso isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 )
En una entropía constante , es decir, en un proceso isentrópico, el cambio de entalpía es igual al trabajo del proceso de flujo realizado en o por el sistema:
Proceso isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 )

La entalpía se puede convertir en una variable intensiva o específica dividiéndola por la masa . Los ingenieros usan la entalpía específica en el análisis termodinámico más que la entalpía misma. La eficiencia térmica de un ciclo Brayton tan simple, para gas ideal y en términos de entalpías específicas, ahora se puede expresar en términos de temperaturas:
Cálculo del ciclo de Rankine
El ciclo de Rankine describe de cerca los procesos en motores de calor operados por vapor que se encuentran comúnmente en la mayoría de las centrales térmicas . Las fuentes de calor utilizadas en estas centrales eléctricas suelen ser la combustión de combustibles fósiles como el carbón, el gas natural o también la fisión nuclear .
Una planta de energía nuclear (estación de energía nuclear) se parece a una estación de energía térmica estándar con una excepción. La fuente de calor en la central nuclear es un reactor nuclear . Como es típico en todas las centrales térmicas convencionales, el calor se utiliza para generar vapor que impulsa una turbina de vapor conectada a un generador que produce electricidad.
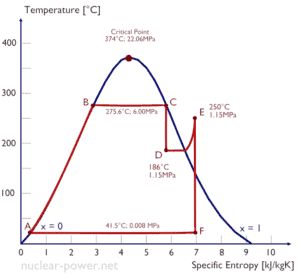
Típicamente, la mayoría de las plantas de energía nuclear opera turbinas de vapor de condensación de etapas múltiples . En estas turbinas, la etapa de alta presión recibe vapor (este vapor es vapor casi saturado – x = 0.995 – punto C en la figura; 6 MPa ; 275.6 ° C) desde un generador de vapor y lo expulsa al separador-recalentador de humedad (punto D ) El vapor debe recalentarse para evitar daños que puedan ocasionar a las aspas de la turbina de vapor el vapor de baja calidad . El recalentador calienta el vapor (punto D) y luego el vapor se dirige a la etapa de baja presión de la turbina de vapor, donde se expande (punto E a F). El vapor agotado se condensa en el condensador y está a una presión muy por debajo de la atmosférica (presión absoluta de0.008 MPa ), y está en un estado parcialmente condensado (punto F), típicamente de una calidad cercana al 90%.
En este caso, los generadores de vapor, la turbina de vapor, los condensadores y las bombas de agua de alimentación constituyen un motor térmico, sujeto a las limitaciones de eficiencia impuestas por la segunda ley de la termodinámica . En el caso ideal (sin fricción, procesos reversibles, diseño perfecto), este motor térmico tendría una eficiencia de Carnot de
= 1 – T frío / T caliente = 1 – 315/549 = 42.6%
donde la temperatura del depósito caliente es 275.6 ° C (548.7K), la temperatura del depósito frío es 41.5 ° C (314.7K). Pero la central nuclear es el motor térmico real , en el que los procesos termodinámicos son de alguna manera irreversibles. No se hacen infinitamente lento. En dispositivos reales (como turbinas, bombas y compresores) una fricción mecánica y pérdidas de calor causan pérdidas adicionales de eficiencia.
Para calcular la eficiencia térmica del ciclo de Rankine más simple (sin recalentamiento), los ingenieros utilizan la primera ley de la termodinámica en términos de entalpía en lugar de en términos de energía interna.
La primera ley en términos de entalpía es:
dH = dQ + Vdp
En esta ecuación, el término Vdp es un proceso de flujo de trabajo. Este trabajo, Vdp , se utiliza para sistemas de flujo abierto como una turbina o una bomba en la que hay un “dp” , es decir, un cambio de presión. No hay cambios en el volumen de control . Como puede verse, esta forma de ley simplifica la descripción de la transferencia de energía . A presión constante , el cambio de entalpía es igual a la energía transferida del ambiente a través del calentamiento:
Proceso isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
En una entropía constante , es decir, en un proceso isentrópico, el cambio de entalpía es igual al trabajo del proceso de flujo realizado en o por el sistema:
Proceso isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Es obvio, será muy útil en el análisis de los dos ciclos termodinámicos utilizados en la ingeniería de energía, es decir, en el ciclo de Brayton y el ciclo de Rankine.
La entalpía se puede convertir en una variable intensiva o específica dividiéndola por la masa . Los ingenieros usan la entalpía específica en el análisis termodinámico más que la entalpía misma. Se tabula en las tablas de vapor junto con un volumen específico y una energía interna específica . La eficiencia térmica de dicho ciclo simple de Rankine y en términos de entalpías específicas sería:
Es una ecuación muy simple y para determinar la eficiencia térmica puede usar datos de tablas de vapor .
En las centrales nucleares modernas, la eficiencia térmica general es de aproximadamente un tercio (33%), por lo que se necesitan 3000 MWth de energía térmica de la reacción de fisión para generar 1000 MWe de energía eléctrica. La razón radica en una temperatura de vapor relativamente baja ( 6 MPa ; 275.6 ° C). Se pueden lograr mayores eficiencias aumentando la temperaturadel vapor Pero esto requiere un aumento de las presiones dentro de las calderas o generadores de vapor. Sin embargo, las consideraciones metalúrgicas ponen límites superiores a tales presiones. En comparación con otras fuentes de energía, la eficiencia térmica del 33% no es mucho. Pero debe tenerse en cuenta que las centrales nucleares son mucho más complejas que las centrales de combustibles fósiles y es mucho más fácil quemar combustibles fósiles que generar energía a partir de combustibles nucleares. Las plantas de energía de combustible fósil subcrítico, que funcionan bajo presión crítica (es decir, por debajo de 22.1 MPa), pueden lograr una eficiencia de 36 a 40%.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.