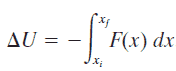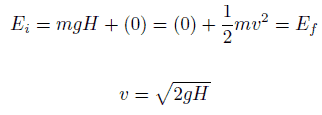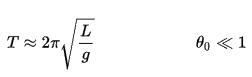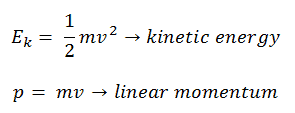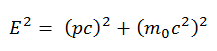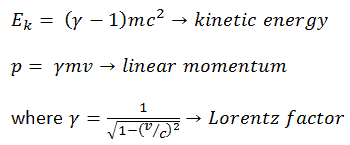Eau
 L’eau est une substance transparente et presque incolore composée des éléments chimiques hydrogène et oxygène , liés par des liaisons covalentes . Sur Terre, l’eau existe à l’état gazeux ( vapeur ou vapeur d’eau ), liquide et solide (glace). C’est l’un des composés les plus abondants et les plus essentiels et c’est le principal constituant des cours d’eau, des lacs et des océans de la Terre, ainsi que des fluides de la plupart des organismes vivants. C’est vital pour toutes les formes de vie connues.
L’eau est une substance transparente et presque incolore composée des éléments chimiques hydrogène et oxygène , liés par des liaisons covalentes . Sur Terre, l’eau existe à l’état gazeux ( vapeur ou vapeur d’eau ), liquide et solide (glace). C’est l’un des composés les plus abondants et les plus essentiels et c’est le principal constituant des cours d’eau, des lacs et des océans de la Terre, ainsi que des fluides de la plupart des organismes vivants. C’est vital pour toutes les formes de vie connues.
En plus d’être essentielle à la vie, l’eau est une substance remarquable avec de nombreuses propriétés surprenantes.
- C’est le seul composé chimique présent naturellement dans les trois états physiques : gazeux (vapeur d’eau ou vapeur d’eau), liquide et solide (glace).
- C’est le seul liquide inorganique présent naturellement sur la Terre.
- L’eau diffère également de la plupart des liquides en ce sens qu’elle devient moins dense à mesure qu’elle gèle . Sa densité maximale est de 3,98 ° C (1 000 kg / m 3 ), alors que celle de la glace est de 917 kg / m 3 . Il diffère d’environ 9% et la glace flotte donc sur l’ eau liquide
- L’eau a la chaleur spécifique la plus élevée de toutes les substances courantes – 4,19 kJ / kg K.
- Il a de très haute chaleur de vaporisation, ce qui en fait un refroidissement efficace et moyenne dans les centrales thermiques et autres industrie de l’ énergie.
Utilisations de l’eau en génie nucléaire
L’eau comme fluide de refroidissement du réacteur
L’eau et la vapeur sont un fluide commun utilisé pour l’échange de chaleur dans le circuit primaire (de la surface des crayons combustibles au flux de liquide de refroidissement) et dans le circuit secondaire. Il est utilisé en raison de sa disponibilité et de sa capacité thermique élevée, tant pour le refroidissement que pour le chauffage. Il est particulièrement efficace pour transporter la chaleur par vaporisation et condensation de l’eau en raison de sa très grande chaleur latente de vaporisation .
Un inconvénient est que les réacteurs à eau modérée doivent utiliser un circuit primaire à haute pression pour maintenir l’eau à l’ état liquide et pour atteindre une efficacité thermodynamique suffisante. L’eau et la vapeur réagissent également avec les métaux que l’on trouve couramment dans les industries comme l’acier et le cuivre, qui sont oxydés plus rapidement par l’eau et la vapeur non traitées. Dans presque toutes les centrales thermiques (charbon, gaz, nucléaire), l’eau est utilisée comme fluide de travail (utilisé en boucle fermée entre la chaudière, la turbine à vapeur et le condenseur) et le liquide de refroidissement (utilisé pour échanger la chaleur perdue vers un plan d’eau). ou l’emporter par évaporation dans une tour de refroidissement).
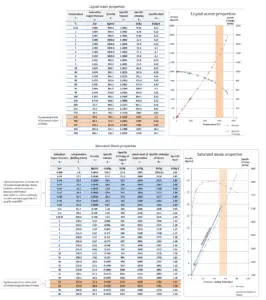
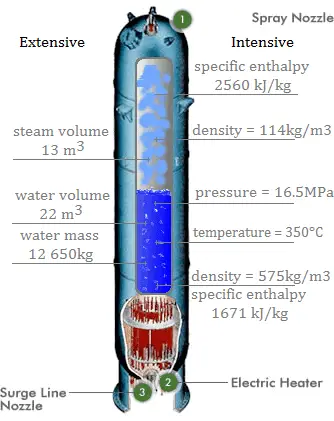
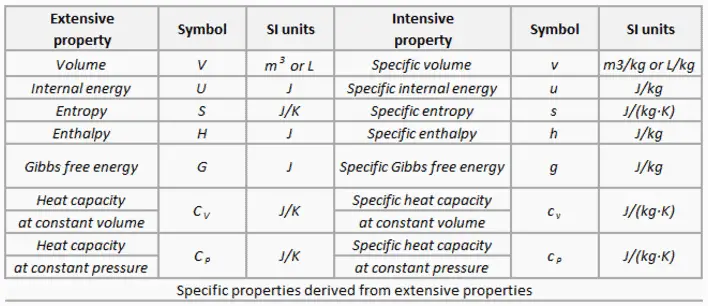
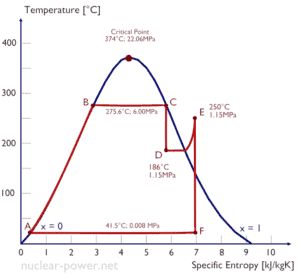
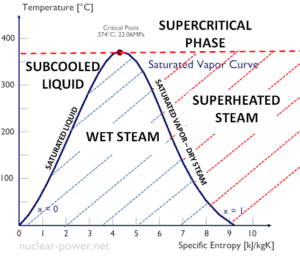
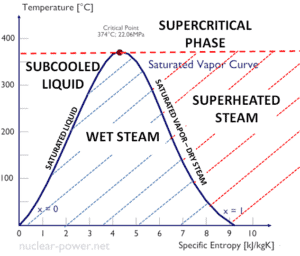
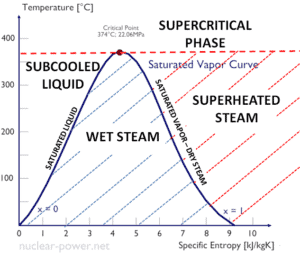
L’eau et la vapeur sont un milieu commun car leurs propriétés sont très connues . Leurs propriétés sont tabulées dans ce qu’on appelle des « tables de vapeur ». Dans ces tableaux, les propriétés de base et clés, telles que la pression, la température, l’enthalpie, la densité et la chaleur spécifique, sont présentées sous forme de tableau de la courbe de saturation vapeur-liquide en fonction de la température et de la pression. Les propriétés sont également présentées sous forme de tableau pour les états monophasés ( eau comprimée ou vapeur surchauffée) sur une grille de températures et de pressions allant jusqu’à 2000 ºC et 1000 MPa.
D’autres données complètes et faisant autorité peuvent être trouvées sur la page du NIST Webbook sur les propriétés thermophysiques des fluides.
Voir aussi: Tables Steam
L’eau comme modérateur
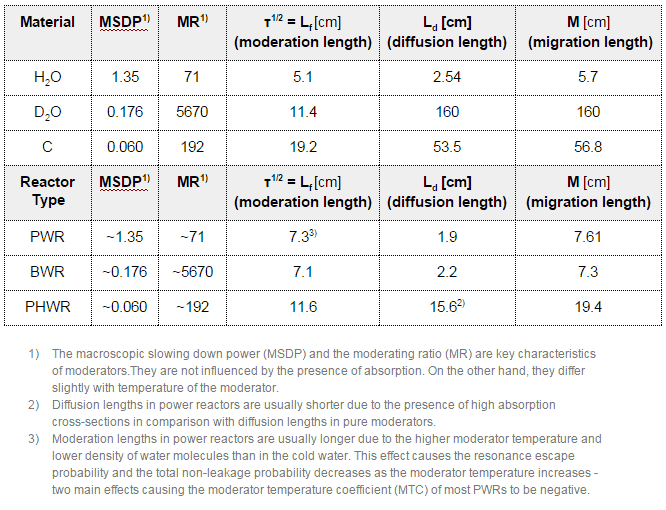
Le modérateur de neutrons , important dans les réacteurs thermiques , est utilisé pour modérer, c’est-à-dire pour ralentir les neutrons de la fission aux énergies thermiques . Les noyaux avec de faibles nombres de masse sont les plus efficaces à cet effet, donc le modérateur est toujours un matériau à faible masse. Les modérateurs couramment utilisés comprennent l’ eau ordinaire (légère) (environ 75% des réacteurs mondiaux), le graphite solide (20% des réacteurs) et l’eau lourde (5% des réacteurs).
Dans la plupart des réacteurs nucléaires , l’eau est à la fois un réfrigérant et un modérateur . La modération se produit surtout sur les noyaux d’hydrogène. Dans le cas de l’ hydrogène (A = 1) comme noyau cible, le neutron incident peut être complètement arrêté – il a le décrément d’énergie logarithmique moyen le plus élevé de tous les noyaux. D’un autre côté, les noyaux d’hydrogène ont une section efficace d’absorption relativement plus élevée , donc l’eau n’est pas le meilleur modérateur selon le rapport de modération .
L’eau comme bouclier neutronique
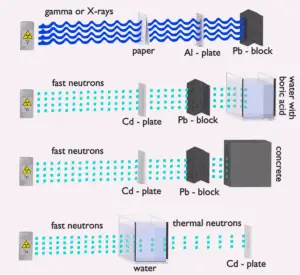
L’eau en raison de la teneur élevée en hydrogène et de la disponibilité est un blindage neutronique efficace et commun . Cependant, en raison du faible nombre atomique d’hydrogène et d’oxygène, l’eau n’est pas un bouclier acceptable contre les rayons gamma. D’autre part, dans certains cas, cet inconvénient (faible densité) peut être compensé par une épaisseur élevée du bouclier étanche à l’eau. Dans le cas des neutrons, l’eau modère parfaitement les neutrons, mais avec l’absorption des neutrons par le noyau d’hydrogène, des rayons gamma secondaires à haute énergie sont produits. Ces rayons gamma pénètrent fortement dans la matière et peuvent donc augmenter les exigences sur l’épaisseur du bouclier d’eau. Ajout d’un acide borique peut aider à résoudre ce problème (absorption de neutrons sur les noyaux de bore sans émission gamma forte), mais entraîne un autre problème de corrosion des matériaux de construction.
Voir aussi: Blindage des neutrons
L’eau comme protection contre les radiations gamma
En bref, un blindage efficace du rayonnement gamma est dans la plupart des cas basé sur l’utilisation de matériaux ayant les deux propriétés suivantes:
- haute densité de matériau.
- nombre atomique élevé de matériaux (matériaux Z élevés)
Bien que l’eau ne soit ni à haute densité ni à forte teneur en Z , elle est couramment utilisée comme écran gamma. L’eau assure la protection contre les radiations des assemblages combustibles dans une piscine de combustible usé pendant le stockage ou pendant les transports depuis et vers le cœur du réacteur . Bien que l’eau soit un matériau à faible densité et à faible teneur en Z, elle est couramment utilisée dans les centrales nucléaires, car ces inconvénients peuvent être compensés par une épaisseur accrue.
Demi couche de valeur d’eau
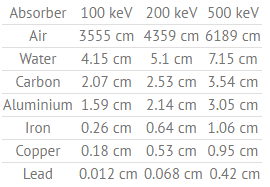
La couche à demi-valeur exprime l’épaisseur du matériau absorbant nécessaire pour réduire l’intensité du rayonnement incident d’un facteur deux .
Tableau des demi-couches de valeur (en cm) pour différents matériaux à des énergies de rayons gamma de 100, 200 et 500 keV.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci