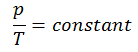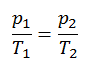Ciclo Otto – Procesos
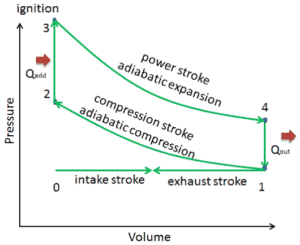
En un ciclo Otto ideal , el sistema que ejecuta el ciclo se somete a una serie de cuatro procesos internamente reversibles: dos procesos isentrópicos (adiabáticos reversibles) alternados con dos procesos isocróricos:
- Compresión isentrópica (carrera de compresión): el gas (mezcla de combustible y aire) se comprime adiabáticamente del estado 1 al estado 2, a medida que el pistón se mueve desde el punto muerto inferior al punto muerto superior. Los alrededores trabajan con el gas, aumentando su energía interna (temperatura) y comprimiéndolo. Por otro lado, la entropía permanece sin cambios. Los cambios en los volúmenes y su relación ( V 1 / V 2 ) se conocen como la relación de compresión.
- Compresión isocórica (fase de ignición): en esta fase (entre el estado 2 y el estado 3) hay una transferencia de calor de volumen constante (el pistón está en reposo) al aire desde una fuente externa mientras el pistón está en reposo en el punto muerto superior . Este proceso está destinado a representar la ignición de la mezcla de combustible y aire inyectada en la cámara y la posterior combustión rápida. La presión aumenta y la relación ( P 3 / P 2 ) se conoce como la “relación de explosión”.
- Expansión isentrópica (golpe de poder): el gas se expande adiabáticamente desde el estado 3 al estado 4, a medida que el pistón se mueve desde el punto muerto superior al punto muerto inferior. El gas funciona en el entorno (pistón) y pierde una cantidad de energía interna igual al trabajo que abandona el sistema. Nuevamente, la entropía permanece sin cambios. La relación de volumen ( V 4 / V 3 ) se conoce como la relación de expansión isentrópica, pero para el ciclo de Otto, es igual a la relación de compresión.
- Descompresión isocórica (carrera de escape) : en esta fase, el ciclo se completa con un proceso de volumen constante en el que el calor se rechaza del aire mientras el pistón está en el punto muerto inferior. La presión de gas de trabajo cae instantáneamente desde el punto 4 al punto 1. La válvula de escape se abre en el punto 4. La carrera de escape es directamente después de esta descompresión. A medida que el pistón se mueve desde el punto muerto inferior (punto 1) al punto muerto superior (punto 0) con la válvula de escape abierta, la mezcla gaseosa se ventila a la atmósfera y el proceso comienza de nuevo.
Durante el ciclo de Otto, el pistón trabaja en el gas entre los estados 1 y 2 ( compresión isentrópica ). El gas realiza el trabajo en el pistón entre las etapas 3 y 4 ( expansión isentrópica ). La diferencia entre el trabajo realizado por el gas y el trabajo realizado sobre el gas es el trabajo neto producido por el ciclo y corresponde al área encerrada por la curva del ciclo. El trabajo producido por el ciclo multiplicado por la velocidad del ciclo (ciclos por segundo) es igual a la potencia producida por el motor Otto.
Proceso isentrópico
Un proceso isentrópico es un proceso termodinámico , en el cual la entropía del fluido o gas permanece constante. Significa que el proceso isentrópico es un caso especial de un proceso adiabático en el que no hay transferencia de calor o materia. Es un proceso adiabático reversible . La suposición de que no hay transferencia de calor es muy importante, ya que podemos usar la aproximación adiabática solo en procesos muy rápidos .
Proceso isentrópico y la primera ley
Para un sistema cerrado, podemos escribir la primera ley de la termodinámica en términos de entalpía :
dH = dQ + Vdp
o
dH = TdS + Vdp
Proceso isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (para gas ideal )
Proceso isentrópico del gas ideal
El proceso isentrópico (un caso especial de proceso adiabático) se puede expresar con la ley de los gases ideales como:
pV κ = constante
o
p 1 V 1 κ = p 2 V 2 κ
en el que κ = c p / c v es la relación de los calores específicos (o capacidades de calor ) para el gas. Uno para presión constante (c p ) y otro para volumen constante (c v ) . Tenga en cuenta que esta relación κ = c p / c v es un factor para determinar la velocidad del sonido en un gas y otros procesos adiabáticos.
Proceso isocorico
Un proceso isocrórico es un proceso termodinámico, en el que el volumen del sistema cerrado permanece constante (V = constante). Describe el comportamiento del gas dentro del contenedor, que no puede deformarse. Como el volumen permanece constante, la transferencia de calor dentro o fuera del sistema no funciona con el p∆V , sino que solo cambia la energía interna (la temperatura) del sistema.
Proceso isocrórico y la primera ley
La forma clásica de la primera ley de la termodinámica es la siguiente ecuación:
dU = dQ – dW
En esta ecuación, dW es igual a dW = pdV y se conoce como el trabajo límite . Luego:
dU = dQ – pdV
En el proceso isocrórico y el gas ideal , todo el calor agregado al sistema se utilizará para aumentar la energía interna.
Proceso isocórico (pdV = 0):
dU = dQ (para gas ideal)
dU = 0 = Q – W → W = Q (para gas ideal)
Proceso isocrórico del gas ideal
El proceso isocrórico se puede expresar con la ley de los gases ideales como:
o
En un diagrama pV , el proceso ocurre a lo largo de una línea horizontal que tiene la ecuación V = constante.
Ver también: Ley de Guy-Lussac
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.