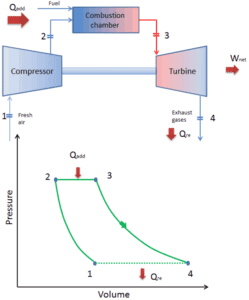
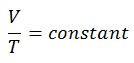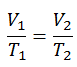Ciclo Brayton – Motor de turbina
En 1872, un ingeniero estadounidense, George Bailey Brayton, avanzó el estudio de los motores térmicos patentando un motor de combustión interna a presión constante, que inicialmente usaba gas vaporizado pero luego usaba combustibles líquidos como el queroseno. Este motor térmico se conoce como ” Motor Listo de Brayton “ . Significa que el motor Brayton original usaba un compresor de pistón y un expansor de pistón en lugar de una turbina de gas y un compresor de gas.
Hoy en día, los modernos motores de turbina de gas y los motores de inyección de aire también son motores de calor de presión constante, por lo tanto, describimos su termodinámica por el ciclo de Brayton . En general, el ciclo de Brayton describe el funcionamiento de un motor térmico de presión constante .
Es uno de los ciclos termodinámicos más comunes que se pueden encontrar en las centrales eléctricas de turbinas de gas o en aviones. A diferencia del ciclo de Carnot , el ciclo de Brayton no ejecuta procesos isotérmicos , ya que estos deben realizarse muy lentamente. En un ciclo Brayton ideal , el sistema que ejecuta el ciclo experimenta una serie de cuatro procesos: dos procesos isentrópicos (adiabáticos reversibles) alternados con dos procesos isobáricos.
Dado que el principio de Carnot establece que ningún motor puede ser más eficiente que un motor reversible ( un motor térmico de Carnot ) que opera entre los mismos depósitos de alta temperatura y baja temperatura, una turbina de gas basada en el ciclo Brayton debe tener una eficiencia menor que la eficiencia de Carnot.
Una gran turbina de gas de un solo ciclo típicamente produce, por ejemplo, 300 megavatios de energía eléctrica y tiene una eficiencia térmica del 35-40%. Las plantas modernas de turbina de gas de ciclo combinado (CCGT), en las que el ciclo termodinámico consta de dos ciclos de planta de energía (por ejemplo, el ciclo Brayton y el ciclo Rankine), pueden lograr una eficiencia térmica de alrededor del 55%.
Ciclo Brayton – Procesos
Ciclo Brayton – Procesos
En un ciclo Brayton ideal cerrado , el sistema que ejecuta el ciclo se somete a una serie de cuatro procesos: dos procesos isentrópicos (adiabáticos reversibles) alternados con dos procesos isobáricos:
-
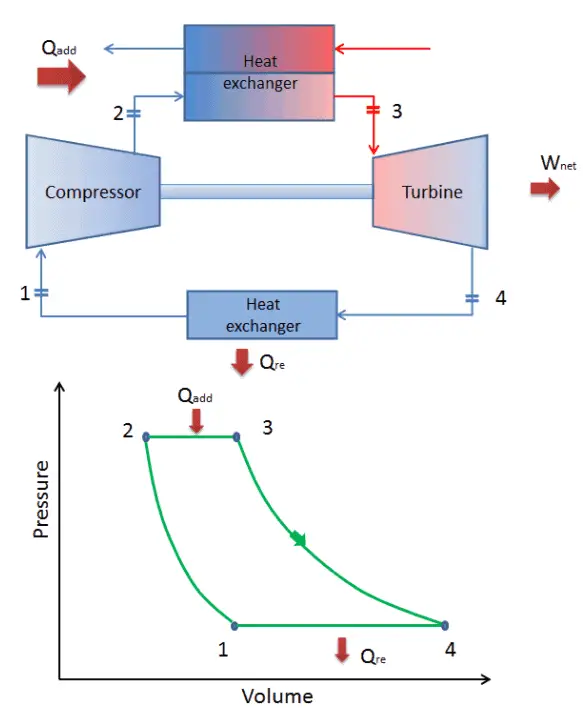
ciclo cerrado de Brayton Compresión isentrópica (compresión en un compresor): el gas de trabajo (por ejemplo, helio) se comprime adiabáticamente desde el estado 1 al estado 2 mediante el compresor (generalmente un compresor de flujo axial). Los alrededores trabajan con el gas, aumentando su energía interna (temperatura) y comprimiéndolo (aumentando su presión). Por otro lado, la entropía permanece sin cambios. El trabajo requerido para el compresor viene dado por W C = H 2 – H 1 .
- Adición de calor isobárico (en un intercambiador de calor): en esta fase (entre el estado 2 y el estado 3) hay una transferencia de calor a presión constante al gas desde una fuente externa, ya que la cámara está abierta para fluir hacia adentro y hacia afuera. En un ciclo Brayton ideal abierto, el aire comprimido pasa a través de una cámara de combustión, donde se quema el combustible y se calienta el aire u otro medio (2 → 3). Es un proceso de presión constante, ya que la cámara está abierta para fluir hacia adentro y hacia afuera. El calor neto agregado viene dado por Q add = H 3 – H 2
- Expansión isentrópica (expansión en una turbina): el gas comprimido y calentado se expande adiabáticamente desde el estado 3 al estado 4 en una turbina. El gas funciona en los alrededores (álabes de la turbina) y pierde una cantidad de energía interna igual al trabajo que abandona el sistema. El trabajo realizado por la turbina viene dado por W T = H 4 – H 3 . Nuevamente, la entropía permanece sin cambios.
- Rechazo de calor isobárico (en un intercambiador de calor) : en esta fase, el ciclo se completa mediante un proceso de presión constante en el que se rechaza el calor del gas. La temperatura del gas de trabajo cae del punto 4 al punto 1. El calor neto rechazado viene dado por Q re = H 4 – H 1
Durante un ciclo de Brayton, el compresor realiza el trabajo en el gas entre los estados 1 y 2 ( i compresión sentrópica ). El gas en la turbina realiza el trabajo entre las etapas 3 y 4 ( i expansión sentrópica ). La diferencia entre el trabajo realizado por el gas y el trabajo realizado sobre el gas es el trabajo neto producido por el ciclo y corresponde al área encerrada por la curva del ciclo (en el diagrama pV).
Como puede verse, es conveniente usar entalpía o entalpía específica y expresar la primera ley en términos de entalpía en el análisis de este ciclo termodinámico. Esta forma de ley simplifica la descripción de la transferencia de energía . A presión constante , el cambio de entalpía es igual a la energía transferida del ambiente a través del calentamiento:
Proceso isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
En una entropía constante , es decir, en un proceso isentrópico, el cambio de entalpía es igual al trabajo del proceso de flujo realizado en o por el sistema:
Proceso isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Ver también: ¿Por qué los ingenieros de energía usan la entalpía? Respuesta: dH = dQ + Vdp
Proceso isentrópico
Un proceso isentrópico es un proceso termodinámico , en el cual la entropía del fluido o gas permanece constante. Significa que el proceso isentrópico es un caso especial de un proceso adiabático en el que no hay transferencia de calor o materia. Es un proceso adiabático reversible . La suposición de que no hay transferencia de calor es muy importante, ya que podemos usar la aproximación adiabática solo en procesos muy rápidos .
Proceso isentrópico y la primera ley
Para un sistema cerrado, podemos escribir la primera ley de la termodinámica en términos de entalpía :
dH = dQ + Vdp
o
dH = TdS + Vdp
Proceso isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (para gas ideal )
Proceso isentrópico del gas ideal
El proceso isentrópico (un caso especial de proceso adiabático) se puede expresar con la ley de los gases ideales como:
pV κ = constante
o
p 1 V 1 κ = p 2 V 2 κ
en el que κ = c p / c v es la relación de los calores específicos (o capacidades de calor ) para el gas. Uno para presión constante (c p ) y otro para volumen constante (c v ) . Tenga en cuenta que esta relación κ = c p / c v es un factor para determinar la velocidad del sonido en un gas y otros procesos adiabáticos.
Proceso isobárico
Un proceso isobárico es un proceso termodinámico , en el cual la presión del sistema permanece constante (p = const). La transferencia de calor dentro o fuera del sistema funciona, pero también cambia la energía interna del sistema.
Dado que hay cambios en la energía interna (dU) y cambios en el volumen del sistema (∆V), los ingenieros a menudo usan la entalpía del sistema, que se define como:
H = U + pV
Proceso isobárico y la primera ley
La forma clásica de la primera ley de la termodinámica es la siguiente ecuación:
dU = dQ – dW
En esta ecuación, dW es igual a dW = pdV y se conoce como el trabajo límite . En un proceso isobárico y el gas ideal, parte del calor agregado al sistema se utilizará para hacer el trabajo y parte del calor agregado aumentará la energía interna (aumentará la temperatura). Por lo tanto, es conveniente utilizar la entalpía en lugar de la energía interna.
Proceso isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
En una entropía constante , es decir, en un proceso isentrópico, el cambio de entalpía es igual al trabajo del proceso de flujo realizado en o por el sistema.
Proceso isobárico del gas ideal
El proceso isobárico se puede expresar con la ley de los gases ideales como:
o
En un diagrama pV , el proceso ocurre a lo largo de una línea horizontal (llamada isobar) que tiene la ecuación p = constante.
Ver también: Ley de Charles
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.