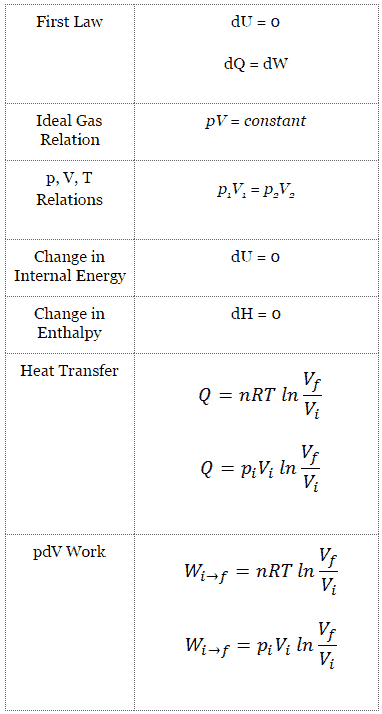Cycle de Carnot – Processus
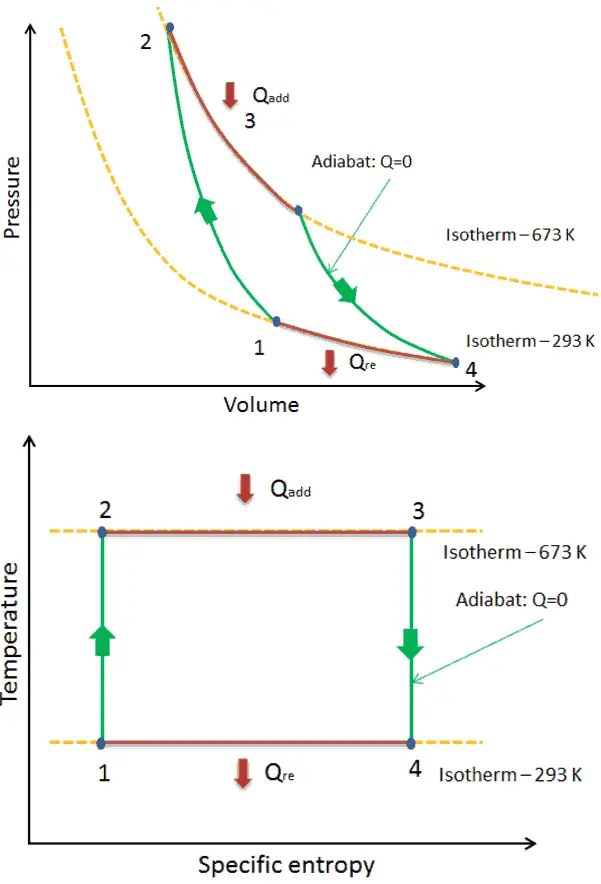 Dans un cycle de Carnot , le système exécutant le cycle subit une série de quatre processus réversibles en interne : deux processus isentropiques (adiabatiques réversibles) alternés avec deux processus isothermes :
Dans un cycle de Carnot , le système exécutant le cycle subit une série de quatre processus réversibles en interne : deux processus isentropiques (adiabatiques réversibles) alternés avec deux processus isothermes :
- compression isentropique – Le gaz est comprimé de manière adiabatique de l’ état 1 à l’ état 2, où la température est T H . Les environs agissent sur le gaz, augmentant son énergie interne et le compressant. En revanche, l’ entropie reste inchangée .
- Détente isotherme – Le système est placé en contact avec le réservoir à T H . Le gaz se dilate de manière isotherme tout en recevant l’énergie Q H du réservoir chaud par transfert de chaleur. La température du gaz ne change pas pendant le processus. Le gaz fonctionne sur l’environnement. Le changement d’entropie total est donné par: ∆S = S 1 – S 4 = Q H / T H
- détente isentropique – le gaz se détend adiabatiquement de l’ état 3 à l’ état 4, où la température est T C . Le gaz travaille sur l’environnement et perd une quantité d’énergie interne égale au travail qui quitte le système. Encore une fois, l’entropie reste inchangée.
- compression isotherme – Le système est placé en contact avec le réservoir à T C . Le gaz se comprime de manière isotherme à son état initial tandis qu’il décharge l’énergie Q C dans le réservoir froid par transfert de chaleur. Dans ce processus, l’environnement travaille sur le gaz. Le changement d’entropie total est donné par: ∆S = S 3 – S 2 = Q C / T C
Processus isentropique
Un processus isentropique est un processus thermodynamique , dans lequel l’ entropiedu fluide ou du gaz reste constante. Cela signifie que le processus isentropique est un cas particulier d’un processus adiabatique dans lequel il n’y a pas de transfert de chaleur ou de matière. Il s’agit d’un processus adiabatique réversible . L’hypothèse d’absence de transfert de chaleur est très importante, car nous ne pouvons utiliser l’approximation adiabatique que dans des processus très rapides .
Processus isentropique et première loi
Pour un système fermé, on peut écrire la première loi de la thermodynamique en termes d’enthalpie :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processus isentropique (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (pour le gaz parfait )
Processus isentropique du gaz parfait
Le processus isentropique (un cas particulier du processus adiabatique) peut être exprimé avec la loi du gaz parfait comme:
pV κ = constant
ou
p 1 V 1 κ = p 2 V 2 κ
dans laquelle κ = c p / c v est le rapport des chaleurs spécifiques (ou capacités calorifiques ) pour le gaz. Un pour une pression constante (c p ) et un pour un volume constant (c v ) . Notez que ce rapport κ = c p / c v est un facteur déterminant la vitesse du son dans un gaz et d’autres processus adiabatiques.
Processus isentropique – principales caractéristiques
Processus isotherme
Un processus isotherme est un processus thermodynamique , dans lequel la température du système reste constante (T = const). Le transfert de chaleur dans ou hors du système doit généralement se produire à un rythme aussi lent afin de s’adapter en permanence à la température du réservoir par échange de chaleur. Dans chacun de ces états, l’ équilibre thermique est maintenu.
Processus isotherme et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites .
Dans le processus isotherme et le gaz parfait , toute la chaleur ajoutée au système sera utilisée pour effectuer les travaux:
Processus isotherme (dU = 0):
dU = 0 = Q – W → W = Q (pour le gaz parfait)
Processus isotherme du gaz parfait
Le processus isotherme peut s’exprimer avec la loi du gaz parfait comme:
pV = constant
ou
p 1 V 1 = p 2 V 2
Sur un diagramme pV, le processus se produit le long d’ une ligne (appelée isotherme) qui a l’équation p = constante / V .
Processus isotherme – principales caractéristiques
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci