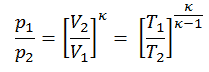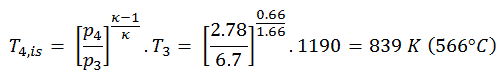Processus isentropique
Un processus isentropique est un processus thermodynamique , dans lequel l’ entropie du fluide ou du gaz reste constante. Cela signifie que le processus isentropique est un cas particulier d’un processus adiabatique dans lequel il n’y a pas de transfert de chaleur ou de matière. Il s’agit d’un processus adiabatique réversible . Un processus isentropique peut également être appelé un processus d’entropie constante. En ingénierie, un tel processus idéalisé est très utile pour la comparaison avec des processus réels.
Puisqu’il y a des changements d’ énergie interne (dU) et des changements de volume du système (∆V), les ingénieurs utilisent souvent l’ enthalpie du système, qui est définie comme:
H = U + pV
Dans de nombreuses analyses thermodynamiques, il est commode d’utiliser l’ enthalpie au lieu de l’énergie interne. Surtout dans le cas de la première loi de la thermodynamique .
Processus isentropique et première loi
La première loi de la thermodynamique en termes d’enthalpie :
dH = dQ + Vdp
ou
dH = TdS + Vdp

Voir aussi: Première loi de la thermodynamique
Voir aussi: Loi sur les gaz parfaits
Voir aussi: Qu’est-ce que l’enthalpie
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (pour le gaz parfait )
Expansion isentropique – Compression isentropique
Voir aussi: Qu’est-ce qu’un gaz parfait
Dans un gaz parfait , les molécules n’ont pas de volume et n’interagissent pas. Selon la loi du gaz parfait , la pression varie linéairement avec la température et la quantité, et inversement avec le volume .
pV = nRT
où:
- p est la pression absolue du gaz
- n est la quantité de substance
- T est la température absolue
- V est le volume
- R est la constante de gaz parfaite ou universelle, égale au produit de la constante de Boltzmann et de la constante d’Avogadro,
Dans cette équation, le symbole R est une constante appelée constante de gaz universelle qui a la même valeur pour tous les gaz, à savoir R = 8,31 J / mol K.
Le processus isentropique (un cas particulier du processus adiabatique) peut être exprimé avec la loi du gaz parfait comme:
pV κ = constant
ou
p 1 V 1 κ = p 2 V 2 κ
dans laquelle κ = c p / c v est le rapport des chaleurs spécifiques (ou capacités calorifiques ) pour le gaz. Un pour une pression constante (c p ) et un pour un volume constant (c v ) . Notez que ce rapport κ = c p / c v est un facteur déterminant la vitesse du son dans un gaz et d’autres processus adiabatiques.
Autre relation p, V, T
Sur un diagramme pV , le processus se produit le long d’une ligne (appelée adiabat ) qui a l’équation p = constante / V κ . Pour un gaz parfait et un processus polytropique, le cas n = κ correspond à un processus isentropique.
Exemple: expansion isentropique dans une turbine à gaz
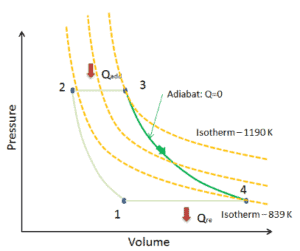
Supposons une expansion isentropique de l’hélium ( 3 → 4 ) dans une turbine à gaz . Étant donné que l’hélium se comporte presque comme un gaz parfait , utilisez la loi du gaz parfait pour calculer la température de sortie du gaz ( T 4, is ). Dans ces turbines, l’étage haute pression reçoit du gaz (point 3 sur la figure; p 3 = 6,7 MPa ; T 3 = 1190 K (917 ° C)) d’un échangeur de chaleur et l’évacue vers un autre échangeur de chaleur, où la pression de sortie est p 4 = 2,78 MPa (point 4) .
Solution:
La température de sortie du gaz, T 4, est , peut être calculée en utilisant p, V, T Relation pour le processus isentropique (processus adiabatique réversible):
Dans cette équation, le facteur pour l’hélium est égal à κ = c p / c v = 1,66 . De l’équation précédente, la température de sortie du gaz, T 4 , est:
Exemple: expansion isentropique dans une turbine à gaz

Supposons le cycle de Brayton idéal qui décrit le fonctionnement d’un moteur thermique à pression constante . Les moteurs à turbine à gaz modernes et les moteurs à réaction à respiration aérodynamique suivent également le cycle de Brayton.
Le cycle de Brayton idéal se compose de quatre processus thermodynamiques. Deux processus isentropiques et deux processus isobares.
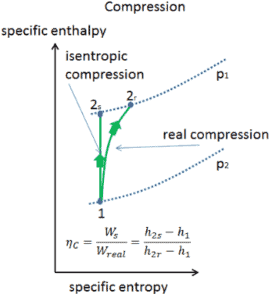
- compression isentropique – l’air ambiant est aspiré dans le compresseur, où il est mis sous pression (1 → 2). Le travail requis pour le compresseur est donné par W C = H 2 – H 1 .
- addition de chaleur isobare – l’air comprimé traverse ensuite une chambre de combustion, où le combustible est brûlé et l’air ou un autre milieu est chauffé (2 → 3). Il s’agit d’un processus à pression constante, car la chambre est ouverte pour entrer et sortir. La chaleur nette ajoutée est donnée par Q add = H 3 – H 2
- expansion isentropique – l’air chauffé sous pression se détend ensuite sur la turbine, cède son énergie. Le travail effectué par turbine est donné par W T = H 4 – H 3
- rejet de chaleur isobare – la chaleur résiduelle doit être rejetée afin de fermer le cycle. La chaleur nette rejetée est donnée par Q re = H 4 – H 1
Comme on peut le voir, nous pouvons décrire et calculer (par exemple l’ efficacité thermique ) de tels cycles (de même pour le cycle de Rankine ) en utilisant des enthalpies .
Voir aussi: Efficacité thermique du cycle de Brayton
Processus isentropiques dans les cycles thermodynamiques
Cycle de Carnot idéal
- Compression isentropique
- Expansion isentropique
Cycle de Rankine idéal
- Compression isentropique dans une pompe
- Expansion isentropique dans une turbine
Cycle de Brayton idéal
- Compression isentropique dans un compresseur
- Expansion isentropique dans une turbine
Cycle Otto idéal
- Compression isentropique
- Expansion isentropique
Cycle diesel idéal
- Compression isentropique
- Expansion isentropique
Efficacité isentropique – Turbine, compresseur, buse
Dans les chapitres précédents, nous avons supposé que l’expansion du gaz est isentropique et nous avons donc utilisé T 4, soit la température de sortie du gaz. Ces hypothèses ne sont applicables qu’avec des cycles idéaux.
La plupart des dispositifs à flux constant (turbines, compresseurs, buses) fonctionnent dans des conditions adiabatiques , mais ils ne sont pas vraiment isentropiques mais sont plutôt idéalisés comme isentropiques à des fins de calcul. Nous définissons les paramètres η T , η C , η N , comme un rapport entre le travail réel effectué par appareil et le travail par appareil lorsqu’il est utilisé dans des conditions isentropiques (dans le cas d’une turbine). Ce rapport est connu sous le nom d’ efficacité turbine isentropique / compresseur / buse .
Ces paramètres décrivent l’efficacité avec laquelle une turbine, un compresseur ou une buse se rapproche d’un dispositif isentropique correspondant. Ce paramètre réduit l’efficacité globale et le rendement de travail. Pour les turbines, la valeur de η T est généralement de 0,7 à 0,9 (70–90%).
Exemple: efficacité de la turbine isentropique
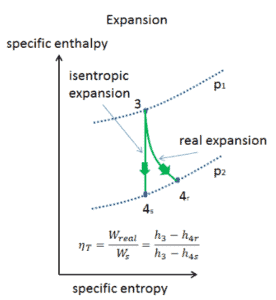
Supposons une expansion isentropique de l’hélium (3 → 4) dans une turbine à gaz. Dans ces turbines, l’étage haute pression reçoit du gaz (point 3 sur la figure; p 3 = 6,7 MPa ; T 3 = 1190 K (917 ° C)) d’un échangeur de chaleur et l’évacue vers un autre échangeur de chaleur, où la pression de sortie est p 4 = 2,78 MPa (point 4) . La température (pour le processus isentropique) du gaz à la sortie de la turbine est T 4s = 839 K (566 ° C).
Calculez le travail effectué par cette turbine et calculez la température réelle à la sortie de la turbine, lorsque le rendement de la turbine isentropique est η T = 0,91 (91%) .
Solution:
A partir de le première principe de la thermodynamique, le travail effectué par turbine dans un processus isentropique peut être calculé à partir de:
W T = h 3 – h 4s → W Ts = c p (T 3 – T 4s )
D’après la loi des gaz parfaits, nous savons que la chaleur spécifique molaire d’un gaz parfait monoatomique est:
C v = 3 / 2R = 12,5 J / mol K et C p = C v + R = 5 / 2R = 20,8 J / mol K
Nous transférons les capacités calorifiques spécifiques en unités de J / kg K via:
c p = C p . 1 / M (poids molaire de l’hélium) = 20,8 x 4,10 -3 = 5200 J / kg K
Le travail effectué par turbine à gaz en procédé isentropique est alors:
W T, s = c p (T 3 – T 4s ) = 5200 x (1190 – 839) = 1,825 MJ / kg
Le travail réel effectué par la turbine à gaz en processus adiabatique est alors:
W T, réel = c p (T 3 – T 4s ). η T = 5200 x (1190 – 839) x 0,91 = 1,661 MJ / kg
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci