Processus isotherme
Pour un gaz parfait et un procédé polytropique, le cas n = 1 correspond à un procédé isotherme (à température constante). Contrairement au processus adiabatique , dans lequel n = κ et un système n’échange pas de chaleur avec son environnement (Q = 0; ∆T ≠ 0 ) , dans un processus isotherme, il n’y a pas de changement dans l’énergie interne (due à ∆T = 0 ) et donc ΔU = 0 (pour les gaz idéaux) et Q ≠ 0. Un processus adiabatique n’est pas nécessairement un processus isotherme, ni un processus isotherme nécessairement adiabatique.
En ingénierie, les changements de phase, tels que l’évaporation ou la fusion, sont des processus isothermes lorsque, comme c’est généralement le cas, ils se produisent à pression et température constantes.
Processus isotherme et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites .
Dans le processus isotherme et le gaz parfait , toute la chaleur ajoutée au système sera utilisée pour effectuer les travaux:
Processus isotherme (dU = 0):
dU = 0 = Q – W → W = Q (pour le gaz parfait)
Le processus isotherme peut s’exprimer avec la loi du gaz parfait comme:
pV = constant
ou
p 1 V 1 = p 2 V 2
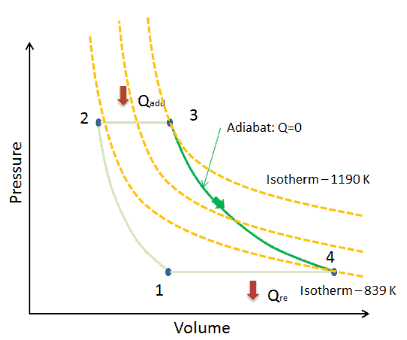
Sur un diagramme pV, le processus se produit le long d’ une ligne (appelée isotherme) qui a l’équation p = constante / V .
Processus adiabatique
Un processus adiabatique est un processus thermodynamique , dans lequel il n’y a pas de transfert de chaleur dans ou hors du système (Q = 0). Le système peut être considéré comme parfaitement isolé . Dans un processus adiabatique, l’énergie n’est transférée que sous forme de travail. L’hypothèse d’absence de transfert de chaleur est très importante, car nous ne pouvons utiliser l’approximation adiabatique que dans des processus très rapides . Dans ces processus rapides, il n’y a pas assez de temps pour que le transfert d’énergie sous forme de chaleur ait lieu vers ou depuis le système.
Dans les appareils réels (tels que les turbines, les pompes et les compresseurs), des pertes de chaleur et des pertes dans le processus de combustion se produisent, mais ces pertes sont généralement faibles par rapport au flux d’énergie global et nous pouvons approximer certains processus thermodynamiques par le processus adiabatique.
Processus adiabatique et première loi
Pour un système fermé, on peut écrire la première loi de la thermodynamique en termes d’enthalpie :
dH = dQ + Vdp
Dans cette équation, le terme Vdp est un travail de processus d’écoulement . Ce travail, Vdp, est utilisé pour des systèmes à flux ouvert comme une turbine ou une pompe dans lesquels il y a un «dp», c’est-à-dire un changement de pression. Comme on peut le voir, cette forme de loi simplifie la description du transfert d’énergie . Dans le processus adiabatique, le changement d’enthalpie est égal au travail du processus d’écoulement effectué sur ou par le système:
Processus adiabatique (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (pour un gaz parfait )
Expansion gratuite – Expansion Joule
Ce sont des processus adiabatiques dans lesquels aucun transfert de chaleur ne se produit entre le système et son environnement et aucun travail n’est effectué sur ou par le système. Ces types de processus adiabatiques sont appelés expansion libre . Il s’agit d’un processus irréversible dans lequel un gaz se détend dans une chambre sous vide isolée. Il est également appelé expansion Joule . Pour un gaz parfait, la température ne change pas (cela signifie que le processus est également isotherme ) , cependant, les vrais gaz subissent un changement de température pendant la détente libre. En expansion libre Q = W = 0, et le première principe exige que:
dE int = 0
Une expansion libre ne peut pas être tracée sur un diagramme PV, car le processus est rapide et non quasi statique. Les états intermédiaires ne sont pas des états d’équilibre, et donc la pression n’est pas clairement définie.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci