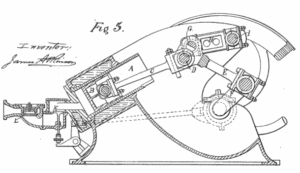
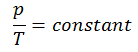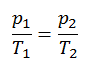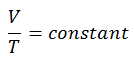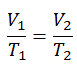Atkinson-Zyklus – Prozesse
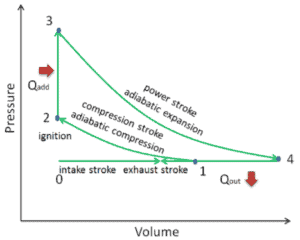
In einem Atkinson-Zyklus (modifizierter Otto-Zyklus) durchläuft das System, das den Zyklus ausführt, eine Reihe von vier Prozessen: zwei isentrope (reversible adiabatische) Prozesse, die sich mit einem isochoren Prozess und einem isobaren Prozess abwechseln:
- Isentrope Kompression (Kompressionshub) – Das Gas (Kraftstoff-Luft-Gemisch) wird adiabatisch von Zustand 1 nach Zustand 2 komprimiert, wenn sich der Kolben vom Schließpunkt des Einlassventils (1) zum oberen Totpunkt bewegt. Die Umgebung arbeitet am Gas, erhöht seine innere Energie (Temperatur) und komprimiert es. Andererseits bleibt die Entropie unverändert. Die Volumenänderungen und ihr Verhältnis ( V 1 / V 2 ) werden als Kompressionsverhältnis bezeichnet . Das Kompressionsverhältnis ist kleiner als das Expansionsverhältnis.
- Isochore Kompression (Zündphase) – In dieser Phase (zwischen Zustand 2 und Zustand 3) erfolgt eine Wärmeübertragung mit konstantem Volumen (der Kolben befindet sich in Ruhe) von einer externen Quelle auf die Luft, während sich der Kolben im oberen Totpunkt in Ruhe befindet . Dieser Prozess ähnelt dem isochoren Prozess im Otto-Zyklus. Es soll die Zündung des in die Kammer eingespritzten Kraftstoff-Luft-Gemisches und das anschließende schnelle Verbrennen darstellen. Der Druck steigt und das Verhältnis ( P 3 / P 2 ) wird als “Explosionsverhältnis” bezeichnet.
- Isentropische Expansion (Krafthub) – Das Gas expandiert adiabatisch von Zustand 3 zu Zustand 4, wenn sich der Kolben vom oberen Totpunkt zum unteren Totpunkt bewegt. Das Gas wirkt auf die Umgebung (Kolben) und verliert eine Menge an interner Energie, die der Arbeit entspricht, die das System verlässt. Auch hier bleibt die Entropie unverändert. Das Volumenverhältnis ( V 4 / V 3 ) ist als isentropes Expansionsverhältnis bekannt.
- Isobares Abgas (Abgashub) – Das Hauptziel des modernen Atkinson-Zyklus besteht darin, dass der Druck in der Brennkammer am Ende des Arbeitshubs dem atmosphärischen Druck entspricht. Da in der Kammer atmosphärischer Druck herrschen kann, erfolgt keine Dekompression wie bei einem Otto-Zyklus. Der Kolben bewegt sich vom unteren Totpunkt (UT) zum oberen Totpunkt (OT) und der Zyklus passiert die Punkte 4 → 1 → 0. Bei diesem Hub ist das Auslassventil geöffnet, während der Kolben ein Abgas aus der Kammer zieht.
Während des Atkinson-Zyklus wird vom Kolben zwischen den Zuständen 1 und 2 ( isentropische Kompression ) am Gas gearbeitet . Die Arbeit am Gas am Kolben erfolgt zwischen den Stufen 3 und 4 ( isentropische Expansion ). Der Unterschied zwischen der vom Gas geleisteten Arbeit und der am Gas geleisteten Arbeit ist das vom Kreislauf erzeugte Netz und entspricht der von der Kreislaufkurve umschlossenen Fläche. Die durch den Zyklus erzeugte Arbeit multipliziert mit der Geschwindigkeit des Zyklus (Kreisprozessen pro Sekunde) entspricht der vom Atkinson-Motor erzeugten Leistung.
Isentropischer Prozess
Ein isentropischer Prozess ist ein thermodynamischer Prozess , bei dem die Entropie des Fluids oder Gases konstant bleibt. Dies bedeutet, dass der isentrope Prozess ein Sonderfall eines adiabatischen Prozesses ist, bei dem keine Wärme- oder Materieübertragung stattfindet. Es ist ein reversibler adiabatischer Prozess . Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Näherung nur in sehr schnellen Prozessen verwenden können .
Isentropischer Prozess und das erste Gesetz
Für ein geschlossenes System können wir den ersten Hauptsatz der Thermodynamik in Bezug auf die Enthalpie schreiben :
dH = dQ + Vdp
oder
dH = TdS + Vdp
Isentropischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (für ideales Gas )
Isentropischer Prozess des idealen Gases
Der isentrope Prozess (ein Sonderfall des adiabatischen Prozesses) kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV κ = konstant
oder
p 1 V 1 κ = p 2 V 2 κ
wobei κ = c p / c v das Verhältnis der spezifischen Wärme (oder Wärmekapazitäten ) für das Gas ist. Eine für konstanten Druck (c p ) und eine für konstantes Volumen (c v ) . Es ist zu beachten, dass dieses Verhältnis κ = c p / c v ein Faktor bei der Bestimmung der Schallgeschwindigkeit in einem Gas und anderen adiabatischen Prozessen ist.
Isochorischer Prozess
Ein isochorer Prozess ist ein thermodynamischer Prozess, bei dem das Volumen des geschlossenen Systems konstant bleibt (V = const). Es beschreibt das Verhalten von Gas im Behälter, das nicht verformt werden kann. Da das Volumen konstant bleibt, funktioniert der Wärmeübergang in oder aus dem System nicht mit p∆V , sondern ändert nur die innere Energie (die Temperatur) des Systems.
Isochorischer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit . Dann:
dU = dQ – pdV
Beim isochoren Prozess und beim idealen Gas wird die gesamte dem System zugeführte Wärme zur Erhöhung der inneren Energie verwendet.
Isochorischer Prozess (pdV = 0):
dU = dQ (für ideales Gas)
dU = 0 = Q – W → W = Q (für ideales Gas)
Isochorischer Prozess des idealen Gases
Der isochore Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
oder
In einem pV-Diagramm erfolgt der Prozess entlang einer horizontalen Linie mit der Gleichung V = konstant.
Siehe auch: Guy-Lussacs Gesetz
Isobarer Prozess
Ein isobarer Prozess ist ein thermodynamischer Prozess , bei dem der Druck des Systems konstant bleibt (p = const). Die Wärmeübertragung in oder aus dem System funktioniert zwar, verändert aber auch die innere Energie des Systems.
Da sich die innere Energie (dU) und das Systemvolumen (∆V) ändern, verwenden Ingenieure häufig die Enthalpie des Systems, die wie folgt definiert ist:
H = U + pV
Isobarer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit . Bei einem isobaren Prozess und dem idealen Gas wird ein Teil der dem System zugeführten Wärme für die Arbeit verwendet, und ein Teil der zugeführten Wärme erhöht die innere Energie (erhöht die Temperatur). Daher ist es zweckmäßig, die Enthalpie anstelle der inneren Energie zu verwenden.
Isobarer Prozess (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Bei konstanter Entropie , dh im isentropischen Prozess, entspricht die Enthalpieänderung der am oder vom System durchgeführten Flussprozessarbeit .
Isobarer Prozess des idealen Gases
Der isobare Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
oder
In einem pV-Diagramm erfolgt der Prozess entlang einer horizontalen Linie (Isobare genannt) mit der Gleichung p = Konstante.
Siehe auch: Charles ‘Gesetz
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.