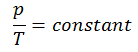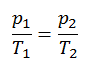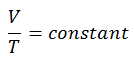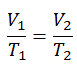Cycle d’Atkinson – Processus
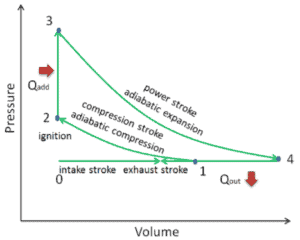
Dans un cycle d’Atkinson ( cycle Otto modifié), le système exécutant le cycle subit une série de quatre processus: deux processus isentropiques (adiabatiques réversibles) alternés avec un processus isochore et un processus isobare:
- Compression isentropique (course de compression) – Le gaz (mélange carburant-air) est comprimé de manière adiabatique de l’état 1 à l’état 2, lorsque le piston se déplace du point de fermeture de la soupape d’admission (1) au point mort haut. Les environs agissent sur le gaz, augmentant son énergie interne (température) et le compressant. En revanche, l’entropie reste inchangée. L’évolution des volumes et de son rapport ( V 1 / V 2 ) est connue sous le nom de taux de compression . Le taux de compression est inférieur au taux d’expansion.
- Compression isochore (phase d’allumage) – Dans cette phase (entre l’état 2 et l’état 3), il y a un transfert de chaleur à volume constant (le piston est au repos) vers l’air à partir d’une source externe tandis que le piston est au repos au point mort haut . Ce processus est similaire au processus isochore du cycle d’Otto. Il est destiné à représenter l’inflammation du mélange carburant-air injecté dans la chambre et la combustion rapide qui en résulte. La pression augmente et le rapport ( P 3 / P 2 ) est appelé «rapport d’explosion».
- Expansion isentropique (course de puissance) – Le gaz se détend adiabatiquement de l’état 3 à l’état 4, lorsque le piston se déplace du point mort haut au point mort bas. Le gaz travaille sur l’environnement (piston) et perd une quantité d’énergie interne égale au travail qui quitte le système. Encore une fois, l’entropie reste inchangée. Le rapport volumique ( V 4 / V 3 ) est connu comme le rapport d’expansion isentropique.
- Échappement isobare (course d’échappement) – L’objectif principal du cycle Atkinson moderne est de permettre à la pression dans la chambre de combustion à la fin de la course de puissance d’être égale à la pression atmosphérique. Puisqu’il peut y avoir de la pression atmosphérique dans la chambre, il n’y a donc pas de décompression comme dans un cycle Otto. Le piston se déplace du point mort bas (BDC) au point mort haut (TDC) et le cycle passe aux points 4 → 1 → 0. Dans cette course, la soupape d’échappement est ouverte tandis que le piston tire les gaz d’échappement hors de la chambre.
Pendant le cycle Atkinson , un travail est effectué sur le gaz par le piston entre les états 1 et 2 ( compression isentropique ). Le travail se fait par le gaz sur le piston entre les étapes 3 et 4 ( détente isentropique ). La différence entre le travail effectué par le gaz et le travail effectué sur le gaz est le travail net produit par le cycle et il correspond à la zone délimitée par la courbe du cycle. Le travail produit par le cycle multiplie la vitesse du cycle (cycles par seconde) par la puissance produite par le moteur Atkinson.
Processus isentropique
Un processus isentropique est un processus thermodynamique , dans lequel l’ entropie du fluide ou du gaz reste constante. Cela signifie que le processus isentropique est un cas particulier d’un processus adiabatique dans lequel il n’y a pas de transfert de chaleur ou de matière. Il s’agit d’un processus adiabatique réversible . L’hypothèse d’absence de transfert de chaleur est très importante, car nous ne pouvons utiliser l’approximation adiabatique que dans des processus très rapides .
Processus isentropique et première loi
Pour un système fermé, on peut écrire la première loi de la thermodynamique en termes d’enthalpie :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processus isentropique (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (pour le gaz parfait )
Processus isentropique du gaz parfait
Le processus isentropique (un cas particulier du processus adiabatique) peut être exprimé avec la loi du gaz parfait comme:
pV κ = constant
ou
p 1 V 1 κ = p 2 V 2 κ
dans laquelle κ = c p / c v est le rapport des chaleurs spécifiques (ou capacités calorifiques ) pour le gaz. Un pour une pression constante (c p ) et un pour un volume constant (c v ) . Notez que ce rapport κ = c p / c v est un facteur déterminant la vitesse du son dans un gaz et d’autres processus adiabatiques.
Processus isochorique
Un processus isochore est un processus thermodynamique, dans lequel le volume du système fermé reste constant (V = const). Il décrit le comportement du gaz à l’intérieur du conteneur, qui ne peut pas être déformé. Étant donné que le volume reste constant, le transfert de chaleur dans ou hors du système ne fonctionne pas avec le p∆V , mais modifie uniquement l’ énergie interne (la température) du système.
Processus isochorique et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites . Alors:
dU = dQ – pdV
Dans le processus isochore et le gaz parfait , toute la chaleur ajoutée au système sera utilisée pour augmenter l’énergie interne.
Processus isochorique (pdV = 0):
dU = dQ (pour le gaz parfait)
dU = 0 = Q – W → W = Q (pour le gaz parfait)
Processus isochorique du gaz parfait
Le processus isochore peut s’exprimer avec la loi du gaz parfait comme:
ou
Sur un diagramme pV , le processus se produit le long d’une ligne horizontale qui a l’équation V = constante.
Voir aussi: Loi de Guy-Lussac
Processus isobare
Un processus isobare est un processus thermodynamique , dans lequel la pression du système reste constante (p = const). Le transfert de chaleur dans ou hors du système fonctionne, mais modifie également l’énergie interne du système.
Puisqu’il y a des changements d’ énergie interne (dU) et des changements de volume du système (∆V), les ingénieurs utilisent souvent l’ enthalpie du système, qui est définie comme:
H = U + pV
Processus isobare et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites . Dans un procédé isobare et le gaz parfait, une partie de la chaleur ajoutée au système sera utilisée pour faire le travail et une partie de la chaleur ajoutée augmentera l’ énergie interne (augmentera la température). Par conséquent, il est commode d’utiliser l’ enthalpie au lieu de l’énergie interne.
Processus isobare (Vdp = 0):
dH = dQ → Q = H 2 – H 1
À entropie constante , c’est-à-dire dans un processus isentropique, le changement d’enthalpie est égal au travail de processus d’écoulement effectué sur ou par le système.
Processus isobare du gaz parfait
Le processus isobare peut s’exprimer avec la loi du gaz parfait comme:
ou
Sur un diagramme pV , le processus se produit le long d’une ligne horizontale (appelée isobare) qui a l’équation p = constante.
Voir aussi: Charles’s Law
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci