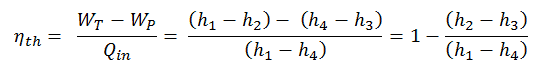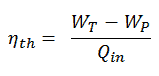Teoria do Ciclo de Rankine
O ciclo Rankine recebeu seu nome e descreve o desempenho de sistemas de turbinas a vapor , embora o princípio teórico também se aplique a motores alternativos, como locomotivas a vapor. Em geral, o ciclo Rankine é um ciclo termodinâmico idealizado de um motor térmico de pressão constante que converte parte do calor em trabalho mecânico. Nesse ciclo, o calor é fornecido externamente a um circuito fechado, que geralmente usa água (na fase líquida e de vapor) como fluido de trabalho. Em contraste com o ciclo de Brayton , o fluido de trabalho no ciclo Rankine passa pela mudança de fase de uma fase líquida para vapor e vice-versa.
Embora muitas substâncias possam ser usadas como fluido de trabalho no ciclo Rankine (inorgânico ou mesmo orgânico), a água é geralmente o fluido de escolha devido às suas propriedades favoráveis, como química não tóxica e não reativa, abundância e baixo custo, bem como suas propriedades termodinâmicas. Por exemplo, a água possui o calor específico mais alto de qualquer substância comum – 4,19 kJ / kg K. Além disso, possui um calor de vaporização muito alto , o que a torna um fluido de arrefecimento eficaz e médio em usinas termelétricas e outras indústrias de energia. No caso do ciclo Rankine, a Lei do Gás Idealquase não pode ser usado (o vapor não segue pV = nRT), portanto, todos os parâmetros importantes de água e vapor são tabulados nas chamadas ” Tabelas de Vapor “.
Uma das principais vantagens do ciclo Rankine é que o processo de compressão na bomba ocorre em um líquido . Ao condensar o vapor de trabalho em um líquido (dentro de um condensador), a pressão na saída da turbina é reduzida e a energia requerida pela bomba de alimentação consome apenas 1% a 3% da potência de saída da turbina e esses fatores contribuem para uma maior eficiência para o ciclo.
Em um ciclo Rankine ideal, o sistema que executa o ciclo passa por uma série de quatro processos: dois processos isentrópicos (adiabáticos reversíveis) alternados com dois processos isobáricos:
-
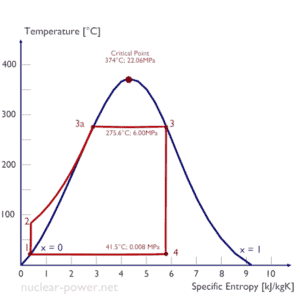
Ciclo de Rankine – Diagrama Ts Compressão isentrópica (compressão em bombas centrífugas) – O condensado líquido é comprimido adiabaticamente do estado 1 ao estado 2 por bombas centrífugas (geralmente por bombas de condensação e depois por bombas de água de alimentação). Os condensados líquidos são bombeados do condensador para a caldeira de alta pressão. Nesse processo, o ambiente trabalha com o fluido, aumentando sua entalpia (h = u + pv) e comprimindo-o (aumentando sua pressão). Por outro lado, a entropia permanece inalterada. O trabalho necessário para o compressor é dado por W Pumps = H 2 – H 1 .
- Adição de calor isobárico (em um trocador de calor – caldeira) – Nesta fase (entre o estado 2 e o estado 3), há uma transferência de calor de pressão constante para o condensado líquido de uma fonte externa, uma vez que a câmara está aberta para entrar e sair . A água de alimentação (circuito secundário) é aquecida até o ponto de ebulição (2 → 3a) desse fluido e depois evaporada na caldeira (3a → 3). O calor líquido adicionado é dado por Q add = H 3 – H 2
- Expansão isentrópica (expansão em uma turbina a vapor) – O vapor da caldeira se expande adiabaticamente do estado 3 para o estado 4 em uma turbina a vapor para produzir trabalho e depois é descarregado no condensador (parcialmente condensado). O vapor trabalha nos arredores (pás da turbina) e perde uma quantidade de entalpia igual ao trabalho que sai do sistema. O trabalho realizado pela turbina é dado por W T = H 4 – H 3 . Novamente a entropia permanece inalterada.
- Rejeição de calor isobárica (em um trocador de calor) – Nesta fase, o ciclo é concluído por um processo de pressão constante no qual o calor é rejeitado pelo vapor parcialmente condensado. Há transferência de calor do vapor para a água de resfriamento que flui em um circuito de resfriamento. O vapor condensa e a temperatura da água de resfriamento aumenta. O calor líquido rejeitado é dado por Q re = H 4 – H 1
Durante um ciclo de Rankine, o trabalho é realizado no fluido pelas bombas entre os estados 1 e 2 ( i compressão sentropic ). O trabalho é feito pelo fluido na turbina entre as fases 3 e 4 ( i expansão sentropic ). A diferença entre o trabalho realizado pelo fluido e o trabalho realizado no fluido é o trabalho líquido produzido pelo ciclo e corresponde à área delimitada pela curva do ciclo (no diagrama pV). O fluido de trabalho em um ciclo Rankine segue um circuito fechado e é reutilizado constantemente.
Como pode ser visto, é conveniente usar a entalpia e a primeira lei em termos de entalpia na análise desse ciclo termodinâmico. Esta forma da lei simplifica a descrição da transferência de energia . A pressão constante , a mudança de entalpia é igual à energia transferida do ambiente através do aquecimento:
Processo isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Na entropia constante , ou seja, no processo isentrópico, a mudança de entalpia é igual ao trabalho do processo de fluxo realizado no ou pelo sistema:
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Veja também: Por que os engenheiros de energia usam entalpia? Resposta: dH = dQ + Vdp
Processo isentrópico
Um processo isentrópico é um processo termodinâmico , no qual a entropia do fluido ou gás permanece constante. Isso significa que o processo isentrópico é um caso especial de um processo adiabático no qual não há transferência de calor ou matéria. É um processo adiabático reversível . A suposição de que não há transferência de calor é muito importante, pois podemos usar a aproximação adiabática apenas em processos muito rápidos .
Processo isentrópico e a primeira lei
Para um sistema fechado, podemos escrever a primeira lei da termodinâmica em termos de entalpia :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Processo isobárico
Um processo isobárico é um processo termodinâmico , no qual a pressão do sistema permanece constante (p = const). A transferência de calor para dentro ou para fora do sistema funciona, mas também altera a energia interna do sistema.
Como existem mudanças na energia interna (dU) e no volume do sistema (∆V), os engenheiros costumam usar a entalpia do sistema, que é definida como:
H = U + pV
Processo isobárico e a primeira lei
A forma clássica da primeira lei da termodinâmica é a seguinte equação:
dU = dQ – dW
Nesta equação, dW é igual a dW = pdV e é conhecido como trabalho de fronteira . Em um processo isobárico e no gás ideal, parte do calor adicionado ao sistema será usada para realizar o trabalho e parte do calor adicionado aumentará a energia interna (aumentará a temperatura). Portanto, é conveniente usar a entalpia em vez da energia interna.
Processo isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Na entropia constante , ou seja, no processo isentrópico, a mudança de entalpia é igual ao trabalho do processo de fluxo realizado no sistema ou pelo mesmo.
Eficiência térmica do ciclo Rankine
Em geral, a eficiência térmica , η th , de qualquer motor de calor é definida como a razão entre o trabalho que faz, W , para o calor de entrada a uma temperatura elevada, Q H .
A eficiência térmica , η th , representa a fração de calor , Q H , que é convertida em trabalho . Como a energia é conservada de acordo com a primeira lei da termodinâmica e a energia não pode ser convertida para funcionar completamente, a entrada de calor, Q H , deve ser igual ao trabalho realizado, W, mais o calor que deve ser dissipado como calor residual Q C no meio Ambiente. Portanto, podemos reescrever a fórmula da eficiência térmica como:
Essa é uma fórmula muito útil, mas aqui expressamos a eficiência térmica usando a primeira lei em termos de entalpia .
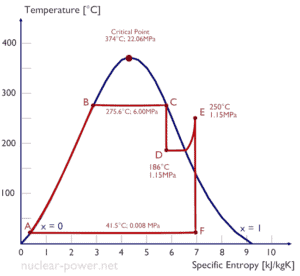
Normalmente, a maioria das usinas nucleares opera turbinas a vapor de condensação de vários estágios . Nessas turbinas, o estágio de alta pressão recebe vapor (esse vapor é quase o vapor saturado – x = 0,995 – ponto C na figura; 6 MPa ; 275,6 ° C) de um gerador de vapor e o esgota no separador-reaquecedor de umidade (ponto D ) O vapor deve ser reaquecido para evitar danos que possam ser causados às pás da turbina a vapor por vapor de baixa qualidade . O reaquecedor aquece o vapor (ponto D) e, em seguida, o vapor é direcionado para o estágio de baixa pressão da turbina a vapor, onde se expande (pontos E a F). O vapor exaurido condensa no condensador e está a uma pressão bem abaixo da atmosférica (pressão absoluta de0,008 MPa ) e está em um estado parcialmente condensado (ponto F), tipicamente com uma qualidade próxima a 90%.
Nesse caso, geradores de vapor, turbinas a vapor, condensadores e bombas de água de alimentação constituem um motor térmico, sujeito às limitações de eficiência impostas pela segunda lei da termodinâmica . No caso ideal (sem atrito, processos reversíveis, design perfeito), este motor térmico teria uma eficiência de Carnot de
= 1 – T frio / T quente = 1 – 315/549 = 42,6%
onde a temperatura do reservatório quente é de 275,6 ° C (548,7 K), a temperatura do reservatório frio é de 41,5 ° C (314,7 K). Mas a usina nuclear é o verdadeiro motor térmico , no qual os processos termodinâmicos são de alguma forma irreversíveis. Eles não são feitos infinitamente devagar. Em dispositivos reais (como turbinas, bombas e compressores), um atrito mecânico e perdas de calor causam mais perdas de eficiência.
Para calcular a eficiência térmica do ciclo Rankine mais simples (sem reaquecer), os engenheiros usam a primeira lei da termodinâmica em termos de entalpia e não em energia interna.
A primeira lei em termos de entalpia é:
dH = dQ + Vdp
Nesta equação, o termo Vdp é um trabalho de processo de fluxo. Este trabalho, Vdp , é usado para sistemas de fluxo aberto como uma turbina ou uma bomba na qual existe um “dp” , ou seja, mudança de pressão. Não há alterações no volume de controle . Como pode ser visto, essa forma de lei simplifica a descrição da transferência de energia . A pressão constante , a mudança de entalpia é igual à energia transferida do ambiente através do aquecimento:
Processo isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Na entropia constante , ou seja, no processo isentrópico, a mudança de entalpia é igual ao trabalho do processo de fluxo realizado no ou pelo sistema:
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
É óbvio que será muito útil na análise de ambos os ciclos termodinâmicos usados na engenharia de energia, ou seja, no ciclo de Brayton e no ciclo de Rankine.
A entalpia pode ser transformada em uma variável intensiva ou específica dividindo-se pela massa . Os engenheiros usam mais a entalpia específica na análise termodinâmica do que a própria entalpia. Ele é tabulado nas tabelas de vapor, juntamente com o volume específico e a energia interna específica . A eficiência térmica desse ciclo simples de Rankine e em termos de entalpias específicas seria:
É uma equação muito simples e, para determinar a eficiência térmica, você pode usar os dados das tabelas de vapor .
Nas modernas usinas nucleares, a eficiência térmica geral é de cerca de um terço (33%); portanto, são necessários 3000 MWth de energia térmica da reação de fissão para gerar 1000 MWe de energia elétrica. O motivo está na temperatura do vapor relativamente baixa ( 6 MPa ; 275,6 ° C). Eficiências mais altas podem ser alcançadas aumentando a temperaturado vapor. Mas isso requer um aumento nas pressões dentro de caldeiras ou geradores de vapor. No entanto, considerações metalúrgicas impõem limites superiores a essas pressões. Em comparação com outras fontes de energia, a eficiência térmica de 33% não é grande. Mas deve-se notar que as usinas nucleares são muito mais complexas que as usinas de combustíveis fósseis e é muito mais fácil queimar combustíveis fósseis do que gerar energia a partir de combustíveis nucleares. As usinas subcríticas de combustíveis fósseis, que são operadas sob pressão crítica (ou seja, inferiores a 22,1 MPa), podem atingir uma eficiência de 36 a 40%.
Ciclo de Rankine – Equações e Cálculo
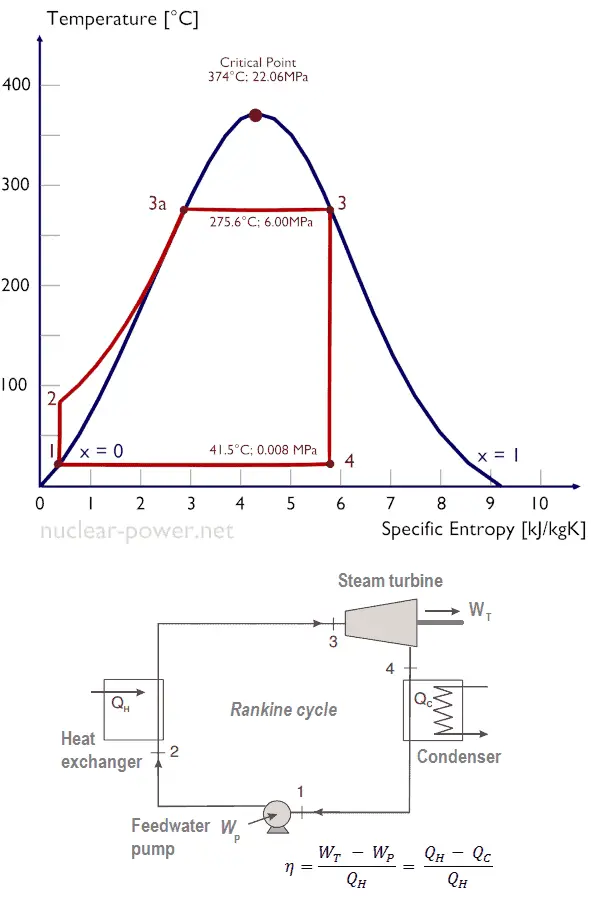 Vamos assumir o ciclo Rankine , que é um dos ciclos termodinâmicos mais comuns em usinas termelétricas. Nesse caso, assuma um ciclo simples, sem reaquecimento e sem a turbina a vapor de condensação funcionando com vapor saturado (vapor seco). Nesse caso, a turbina opera em estado estacionário com condições de entrada de 6 MPa, t = 275,6 ° C, x = 1 (ponto 3). O vapor sai deste estágio da turbina a uma pressão de 0,008 MPa, 41,5 ° C e x = ??? (ponto 4)
Vamos assumir o ciclo Rankine , que é um dos ciclos termodinâmicos mais comuns em usinas termelétricas. Nesse caso, assuma um ciclo simples, sem reaquecimento e sem a turbina a vapor de condensação funcionando com vapor saturado (vapor seco). Nesse caso, a turbina opera em estado estacionário com condições de entrada de 6 MPa, t = 275,6 ° C, x = 1 (ponto 3). O vapor sai deste estágio da turbina a uma pressão de 0,008 MPa, 41,5 ° C e x = ??? (ponto 4)
Calcular:
- a qualidade do vapor do vapor de saída
- a diferença de entalpia entre estes dois estados (3 → 4), a qual corresponde ao trabalho realizado pelo vapor, W t .
- a diferença de entalpia entre estes dois estados (1 → 2), que corresponde ao trabalho feito por bombas, W P .
- a diferença de entalpia entre esses dois estados (2 → 3), que corresponde ao calor líquido adicionado no gerador de vapor
- a eficiência termodinâmica deste ciclo e compare esse valor com a eficiência de Carnot
1)
Como não sabemos a qualidade exata do vapor de saída, precisamos determinar esse parâmetro. O estado 4 é fixado pela pressão p 4 = 0,008 MPa e o fato de que a entropia específica é constante para a expansão isentrópica (s 3 = s 4 = 5,89 kJ / kgK para 6 MPa ). A entropia específica da água líquida saturada (x = 0) e do vapor seco (x = 1) pode ser selecionada nas tabelas de vapor . No caso de vapor úmido, a entropia real pode ser calculada com a qualidade do vapor, x, e as entropias específicas de água líquida saturada e vapor seco:
s 4 = s v x + (1 – x) s l
Onde
s 4 = entropia de vapor úmido (J / kg K) = 5,89 kJ / kgK
s v = entropia do vapor “seco” (J / kg K) = 8,227 kJ / kgK (para 0,008 MPa)
s l = entropia de água líquida saturada (J / kg K) = 0,592 kJ / kgK (para 0,008 MPa)
A partir desta equação, a qualidade do vapor é:
x 4 = ( s 4 – s l ) / ( s v – s l ) = (5,89 – 0,592) / (8,227 – 0,592) = 0,694 = 69,4%
2)
A entalpia para o estado 3 pode ser coletada diretamente das tabelas de vapor, enquanto a entalpia para o estado 4 deve ser calculada usando a qualidade do vapor:
h 3, v = 2785 kJ / kg
h 4, molhado = h 4, v x + (1 – x) h 4, l = 2576. 0,694 + (1 – 0,694). 174 = 1787 + 53,2 = 1840 kJ / kg
Então o trabalho realizado pelo vapor, W T, é
W T = Δh = 945 kJ / kg
3)
A entalpia para o estado 1 pode ser obtida diretamente das tabelas de vapor:
h 1, l = 174 kJ / kg
O estado 2 é fixado pela pressão p 2 = 6,0 MPa e pelo fato de a entropia específica ser constante para a compressão isentrópica (s 1 = s 2 = 0,592 kJ / kgK para 0,008 MPa ). Para esta entropia s 2 = 0,592 kJ / kgK ep 2 = 6,0 MPa, encontramos h 2, sub-resfriado em tabelas de vapor para água comprimida (usando interpolação entre dois estados).
h 2, sub-resfriado = 179,7 kJ / kg
Então, o trabalho realizado pelas bombas, W P, é
W P = Δh = 5,7 kJ / kg
4)
A diferença de entalpia entre (2 → 3), que corresponde ao calor líquido adicionado no gerador de vapor, é simplesmente:
Q add = h 3, v – h 2, sub-resfriado = 2785 – 179,7 = 2605,3 kJ / kg
Observe que, não há regeneração de calor neste ciclo. Por outro lado, a maior parte do calor adicionado é para a entalpia da vaporização (isto é, para a mudança de fase).
5)
Nesse caso, geradores de vapor, turbinas a vapor, condensadores e bombas de água de alimentação constituem um motor térmico, sujeito às limitações de eficiência impostas pela segunda lei da termodinâmica . No caso ideal (sem atrito, processos reversíveis, design perfeito), esse motor térmico teria uma eficiência de Carnot de
η Carnot = 1 – T frio / T quente = 1 – 315/549 = 42,6%
onde a temperatura do reservatório quente é de 275,6 ° C (548,7 K), a temperatura do reservatório frio é de 41,5 ° C (314,7 K).
A eficiência termodinâmica deste ciclo pode ser calculada pela seguinte fórmula:
assim
η th = (945 – 5,7) / 2605,3 = 0,361 = 36,1%
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.