Ciclo Rankine – Processos
Em um ciclo Rankine ideal, o sistema que executa o ciclo passa por uma série de quatro processos: dois processos isentrópicos (adiabáticos reversíveis) alternados com dois processos isobáricos.
Ciclo Rankine – Processos
-
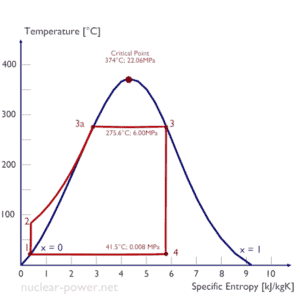
Ciclo de Rankine – Diagrama Ts Compressão isentrópica (compressão em bombas centrífugas) – O condensado líquido é comprimido adiabaticamente do estado 1 ao estado 2 por bombas centrífugas (geralmente por bombas de condensação e depois por bombas de água de alimentação). Os condensados líquidos são bombeados do condensador para a caldeira de alta pressão. Nesse processo, o ambiente trabalha com o fluido, aumentando sua entalpia (h = u + pv) e comprimindo-o (aumentando sua pressão). Por outro lado, a entropia permanece inalterada. O trabalho necessário para o compressor é dado por W Pumps = H 2 – H 1 .
- Adição de calor isobárico (em um trocador de calor – caldeira) – Nesta fase (entre o estado 2 e o estado 3), há uma transferência de calor de pressão constante para o condensado líquido de uma fonte externa, uma vez que a câmara está aberta para entrar e sair . A água de alimentação (circuito secundário) é aquecida até o ponto de ebulição (2 → 3a) desse fluido e depois evaporada na caldeira (3a → 3). O calor líquido adicionado é dado por Q add = H 3 – H 2
- Expansão isentrópica (expansão em uma turbina a vapor) – O vapor da caldeira se expande adiabaticamente do estado 3 para o estado 4 em uma turbina a vapor para produzir trabalho e depois é descarregado no condensador (parcialmente condensado). O vapor trabalha nos arredores (pás da turbina) e perde uma quantidade de entalpia igual ao trabalho que sai do sistema. O trabalho realizado pela turbina é dado por W T = H 4 – H 3 . Novamente a entropia permanece inalterada.
- Rejeição de calor isobárica (em um trocador de calor) – Nesta fase, o ciclo é concluído por um processo de pressão constante no qual o calor é rejeitado pelo vapor parcialmente condensado. Há transferência de calor do vapor para a água de resfriamento que flui em um circuito de resfriamento. O vapor condensa e a temperatura da água de resfriamento aumenta. O calor líquido rejeitado é dado por Q re = H 4 – H 1
Durante um ciclo de Rankine, o trabalho é realizado no fluido pelas bombas entre os estados 1 e 2 ( i compressão sentropic ). O trabalho é feito pelo fluido na turbina entre as fases 3 e 4 ( i expansão sentropic ). A diferença entre o trabalho realizado pelo fluido e o trabalho realizado no fluido é o trabalho líquido produzido pelo ciclo e corresponde à área delimitada pela curva do ciclo (no diagrama pV). O fluido de trabalho em um ciclo Rankine segue um circuito fechado e é reutilizado constantemente.
Como pode ser visto, é conveniente usar a entalpia e a primeira lei em termos de entalpia na análise desse ciclo termodinâmico. Esta forma da lei simplifica a descrição da transferência de energia . A pressão constante , a mudança de entalpia é igual à energia transferida do ambiente através do aquecimento:
Processo isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Na entropia constante , ou seja, no processo isentrópico, a mudança de entalpia é igual ao trabalho do processo de fluxo realizado no ou pelo sistema:
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Veja também: Por que os engenheiros de energia usam entalpia? Resposta: dH = dQ + Vdp
Processo isentrópico
Um processo isentrópico é um processo termodinâmico , no qual a entropia do fluido ou gás permanece constante. Isso significa que o processo isentrópico é um caso especial de um processo adiabático no qual não há transferência de calor ou matéria. É um processo adiabático reversível . A suposição de que não há transferência de calor é muito importante, pois podemos usar a aproximação adiabática apenas em processos muito rápidos .
Processo isentrópico e a primeira lei
Para um sistema fechado, podemos escrever a primeira lei da termodinâmica em termos de entalpia :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Processo isobárico
Um processo isobárico é um processo termodinâmico , no qual a pressão do sistema permanece constante (p = const). A transferência de calor para dentro ou para fora do sistema funciona, mas também altera a energia interna do sistema.
Como existem mudanças na energia interna (dU) e no volume do sistema (∆V), os engenheiros costumam usar a entalpia do sistema, que é definida como:
H = U + pV
Processo isobárico e a primeira lei
A forma clássica da primeira lei da termodinâmica é a seguinte equação:
dU = dQ – dW
Nesta equação, dW é igual a dW = pdV e é conhecido como trabalho de fronteira . Em um processo isobárico e no gás ideal, parte do calor adicionado ao sistema será usada para realizar o trabalho e parte do calor adicionado aumentará a energia interna (aumentará a temperatura). Portanto, é conveniente usar a entalpia em vez da energia interna.
Processo isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Na entropia constante , ou seja, no processo isentrópico, a mudança de entalpia é igual ao trabalho do processo de fluxo realizado no sistema ou pelo mesmo.
Ciclo de Rankine – diagrama pV, Ts
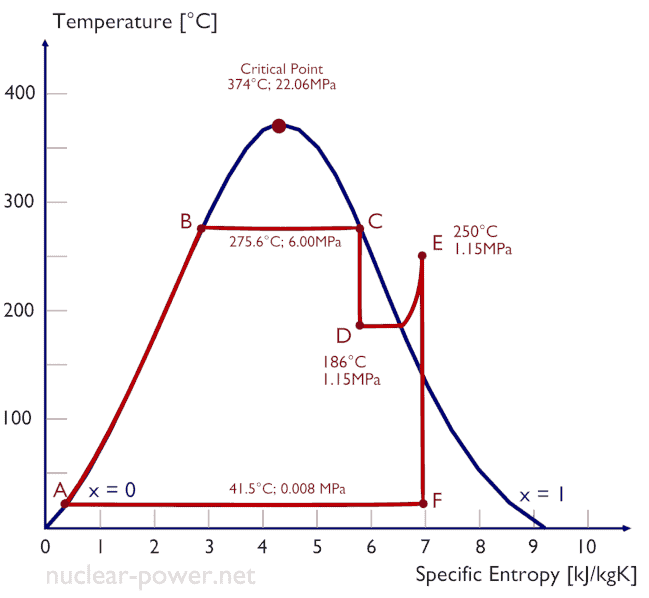
O ciclo Rankine é frequentemente plotado em um diagrama de volume de pressão ( diagrama pV ) e em um diagrama de temperatura-entropia ( diagrama Ts ).
Quando plotados em um diagrama de volume de pressão , os processos isobáricos seguem as linhas isobáricas do gás (as linhas horizontais), os processos adiabáticos se movem entre essas linhas horizontais e a área delimitada pelo caminho completo do ciclo representa o trabalho total que pode ser feito durante um ciclo.
O diagrama de temperatura-entropia ( diagrama Ts) no qual o estado termodinâmico é especificado por um ponto em um gráfico com entropia (s) específica (s) como eixo horizontal e temperatura absoluta (T) como eixo vertical. Os diagramas Ts são uma ferramenta útil e comum, principalmente porque ajuda a visualizar a transferência de calor durante um processo. Para processos reversíveis (ideais), a área sob a curva Ts de um processo é o calor transferido para o sistema durante esse processo.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.