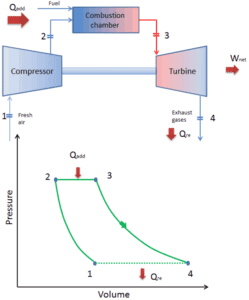
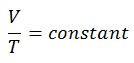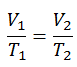Ciclo de Brayton – Motor de turbina
Em 1872, um engenheiro americano, George Bailey Brayton, avançou no estudo de motores térmicos, patenteando um motor de combustão interna de pressão constante, inicialmente usando gás vaporizado, mas posteriormente usando combustíveis líquidos, como o querosene. Esse mecanismo térmico é conhecido como ” Motor Brayton’s Ready “ . Isso significa que o motor Brayton original usava um compressor de pistão e um expansor de pistão em vez de uma turbina a gás e um compressor de gás.
Hoje, os modernos motores de turbina a gás e os motores a jato de respiração também são motores de calor com pressão constante; portanto, descrevemos sua termodinâmica pelo ciclo de Brayton . Em geral, o ciclo de Brayton descreve o funcionamento de um motor térmico de pressão constante .
É um dos ciclos termodinâmicos mais comuns que podem ser encontrados em usinas de turbinas a gás ou em aviões. Ao contrário do ciclo de Carnot , o ciclo de Brayton não executa processos isotérmicos , porque estes devem ser realizados muito lentamente. Em um ciclo de Brayton ideal , o sistema que executa o ciclo passa por uma série de quatro processos: dois processos isentrópicos (adiabáticos reversíveis) alternados com dois processos isobáricos.
Como o princípio de Carnot afirma que nenhum motor pode ser mais eficiente que um motor reversível ( um motor a quente Carnot ) operando entre os mesmos reservatórios de alta temperatura e baixa temperatura, uma turbina a gás baseada no ciclo de Brayton deve ter uma eficiência mais baixa que a eficiência de Carnot.
Uma grande turbina a gás de ciclo único normalmente produz, por exemplo, 300 megawatts de energia elétrica e tem 35 a 40% de eficiência térmica. As modernas instalações de turbinas a gás de ciclo combinado (CCGT), nas quais o ciclo termodinâmico consiste em dois ciclos de usinas de energia (por exemplo, o ciclo de Brayton e o ciclo de Rankine), podem atingir uma eficiência térmica de cerca de 55%.
Ciclo de Brayton – Processos
Ciclo de Brayton – Processos
Em um ciclo de Brayton ideal fechado , o sistema que executa o ciclo passa por uma série de quatro processos: dois processos isentrópicos (adiabáticos reversíveis) alternados com dois processos isobáricos:
-
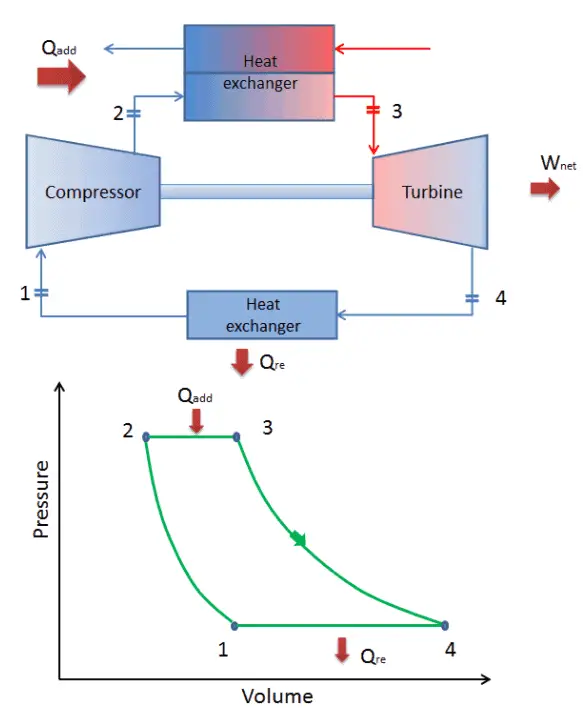
ciclo de Brayton fechado Compressão isentrópica (compressão em um compressor) – O gás de trabalho (por exemplo, hélio) é comprimido adiabaticamente do estado 1 ao estado 2 pelo compressor (geralmente um compressor de fluxo axial). O ambiente trabalha com o gás, aumentando sua energia interna (temperatura) e comprimindo-o (aumentando sua pressão). Por outro lado, a entropia permanece inalterada. O trabalho necessário para o compressor é dado por W C = H 2 – H 1 .
- Adição de calor isobárico (em um trocador de calor) – Nesta fase (entre o estado 2 e o estado 3), há uma transferência de calor de pressão constante para o gás a partir de uma fonte externa, uma vez que a câmara está aberta para entrar e sair. Em um ciclo Brayton ideal aberto, o ar comprimido passa por uma câmara de combustão, onde o combustível é queimado e o ar ou outro meio é aquecido (2 → 3). É um processo de pressão constante, já que a câmara está aberta para entrar e sair. O calor líquido adicionado é dado por Q add = H 3 – H 2
- Expansão isentrópica (expansão em uma turbina) – O gás comprimido e aquecido se expande adiabaticamente do estado 3 para o estado 4 em uma turbina. O gás trabalha nos arredores (pás da turbina) e perde uma quantidade de energia interna igual ao trabalho que sai do sistema. O trabalho realizado pela turbina é dado por W T = H 4 – H 3 . Novamente a entropia permanece inalterada.
- Rejeição de calor isobárica (em um trocador de calor) – Nesta fase, o ciclo é concluído por um processo de pressão constante no qual o calor é rejeitado pelo gás. A temperatura do gás de trabalho cai do ponto 4 para o ponto 1. O calor líquido rejeitado é dado por Q re = H 4 – H 1
Durante um ciclo de Brayton, o trabalho é realizado sobre o gás pelo compressor entre os estados 1 e 2 ( i sentropic compressão ). O trabalho é realizado pelo gás na turbina entre as fases 3 e 4 ( i expansão sentropic ). A diferença entre o trabalho realizado pelo gás e o trabalho realizado no gás é o trabalho líquido produzido pelo ciclo e corresponde à área delimitada pela curva do ciclo (no diagrama pV).
Como pode ser visto, é conveniente usar entalpia ou entalpia específica e expressar a primeira lei em termos de entalpia na análise desse ciclo termodinâmico. Esta forma da lei simplifica a descrição da transferência de energia . A pressão constante , a mudança de entalpia é igual à energia transferida do ambiente através do aquecimento:
Processo isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Na entropia constante , ou seja, no processo isentrópico, a mudança de entalpia é igual ao trabalho do processo de fluxo realizado no ou pelo sistema:
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Veja também: Por que os engenheiros de energia usam entalpia? Resposta: dH = dQ + Vdp
Processo isentrópico
Um processo isentrópico é um processo termodinâmico , no qual a entropia do fluido ou gás permanece constante. Isso significa que o processo isentrópico é um caso especial de um processo adiabático no qual não há transferência de calor ou matéria. É um processo adiabático reversível . A suposição de que não há transferência de calor é muito importante, pois podemos usar a aproximação adiabática apenas em processos muito rápidos .
Processo isentrópico e a primeira lei
Para um sistema fechado, podemos escrever a primeira lei da termodinâmica em termos de entalpia :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processo isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C P (T 2 – T 1 ) (para gás ideal )
Processo isentrópico do gás ideal
O processo isentrópico (um caso especial de processo adiabático) pode ser expresso com a lei dos gases ideais como:
pV κ = constante
ou
p 1 V 1 k = p 2 V 2 k
em que κ = c p / c v é a proporção de aquecimentos específicos (ou capacidades de calor ) para o gás. Um para pressão constante (c p ) e outro para volume constante (c v ) . Observe que essa razão κ = c p / c v é um fator na determinação da velocidade do som em um gás e em outros processos adiabáticos.
Processo isobárico
Um processo isobárico é um processo termodinâmico , no qual a pressão do sistema permanece constante (p = const). A transferência de calor para dentro ou para fora do sistema funciona, mas também altera a energia interna do sistema.
Como existem mudanças na energia interna (dU) e no volume do sistema (∆V), os engenheiros costumam usar a entalpia do sistema, que é definida como:
H = U + pV
Processo isobárico e a primeira lei
A forma clássica da primeira lei da termodinâmica é a seguinte equação:
dU = dQ – dW
Nesta equação, dW é igual a dW = pdV e é conhecido como trabalho de fronteira . Em um processo isobárico e no gás ideal, parte do calor adicionado ao sistema será usada para realizar o trabalho e parte do calor adicionado aumentará a energia interna (aumentará a temperatura). Portanto, é conveniente usar a entalpia em vez da energia interna.
Processo isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Na entropia constante , ou seja, no processo isentrópico, a mudança de entalpia é igual ao trabalho do processo de fluxo realizado no sistema ou pelo mesmo.
Processo isobárico do gás ideal
O processo isobárico pode ser expresso com a lei do gás ideal como:
ou
Em um diagrama de pV , o processo ocorre ao longo de uma linha horizontal (chamada isobar) que possui a equação p = constante.
Veja também: Lei de Charles
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.