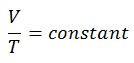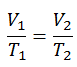Brayton Cycle – Turbinenmotor
1872 brachte der amerikanische Ingenieur George Bailey Brayton die Untersuchung von Wärmekraftmaschinen voran , indem er einen Verbrennungsmotor mit konstantem Druck patentierte, bei dem zunächst verdampftes Gas, später flüssige Brennstoffe wie Kerosin verwendet wurden. Diese Wärmekraftmaschine ist als “ Brayton’s Ready Motor “ bekannt . Dies bedeutet, dass der ursprüngliche Brayton-Motor anstelle einer Gasturbine und eines Gaskompressors einen Kolbenkompressor und einen Kolbenexpander verwendete.
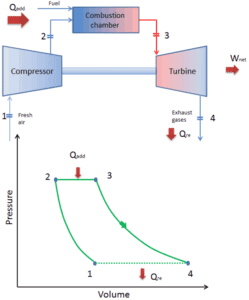
Heute moderne Gasturbinenmotoren und Luftholen Strahltriebwerke sind auch ein Konstantdruck – Wärmemotoren, deshalb wir ihre Thermodynamik vom beschreiben Zyklus Brayton . Im Allgemeinen beschreibt der Brayton-Zyklus die Funktionsweise einer Wärmekraftmaschine mit konstantem Druck .
Es ist einer der häufigsten thermodynamischen Kreisprozessen , die in Gasturbinenkraftwerken oder in Flugzeugen zu finden sind. Im Gegensatz zum Carnot-Zyklus führt der Brayton-Zyklus keine isothermen Prozesse aus , da diese sehr langsam ausgeführt werden müssen. In einem idealen Brayton- Zyklus durchläuft das System, das den Zyklus ausführt, eine Reihe von vier Prozessen: zwei isentrope (reversible adiabatische) Prozesse, die sich mit zwei isobaren Prozessen abwechseln.
Da das Carnot-Prinzip besagt, dass kein Motor effizienter sein kann als ein reversibler Motor ( eine Carnot-Wärmekraftmaschine ), der zwischen denselben Hochtemperatur- und Niedertemperaturspeichern betrieben wird, muss eine auf dem Brayton-Zyklus basierende Gasturbine einen geringeren Wirkungsgrad aufweisen als der Carnot-Wirkungsgrad.
Eine große einzyklische Gasturbine erzeugt typischerweise beispielsweise 300 Megawatt Strom und hat einen thermischen Wirkungsgrad von 35–40%. Moderne kombinierte Gasturbinenanlagen (CCGT), bei denen der thermodynamische Zyklus aus zwei Kraftwerkszyklen besteht (z. B. der Brayton-Zyklus und der Rankine-Zyklus), können einen thermischen Wirkungsgrad von etwa 55% erreichen.
Brayton-Zyklus – Prozesse
Brayton-Zyklus – Prozesse
In einem geschlossenen idealen Brayton- Zyklus durchläuft das System, das den Zyklus ausführt, eine Reihe von vier Prozessen: zwei isentrope (reversible adiabatische) Prozesse, die sich mit zwei isobaren Prozessen abwechseln:
-
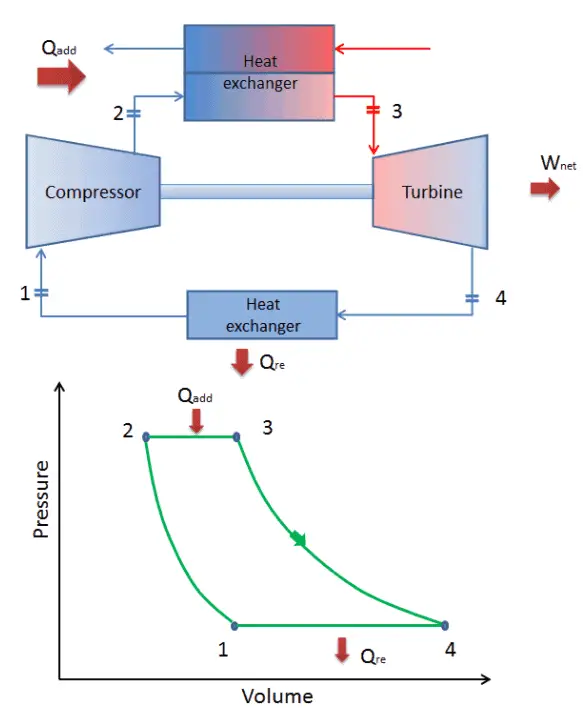
geschlossener Brayton-Zyklus Isentropische Kompression (Kompression in einem Kompressor) – Das Arbeitsgas (z. B. Helium) wird vom Kompressor (normalerweise einem Axialkompressor) adiabatisch von Zustand 1 in Zustand 2 komprimiert. Die Umgebung arbeitet am Gas, erhöht seine innere Energie (Temperatur) und komprimiert es (erhöht seinen Druck). Andererseits bleibt die Entropie unverändert. Die für den Kompressor erforderliche Arbeit ist gegeben durch W C = H 2 – H 1 .
- Isobare Wärmezufuhr (in einem Wärmetauscher) – In dieser Phase (zwischen Zustand 2 und Zustand 3) erfolgt eine Wärmeübertragung mit konstantem Druck von einer externen Quelle auf das Gas, da die Kammer zum Ein- und Ausströmen geöffnet ist. In einem offenen idealen Brayton-Zyklus läuft die Druckluft dann durch eine Brennkammer, in der Kraftstoff verbrannt und Luft oder ein anderes Medium erwärmt wird (2 → 3). Es ist ein Prozess mit konstantem Druck, da die Kammer zum Ein- und Ausströmen geöffnet ist. Die hinzugefügte Nettowärme ist gegeben durch Q add = H 3 – H 2
- Isentropische Expansion (Expansion in einer Turbine) – Das komprimierte und erhitzte Gas expandiert adiabatisch von Zustand 3 zu Zustand 4 in einer Turbine. Das Gas wirkt auf die Umgebung (Schaufeln der Turbine) und verliert eine Menge an interner Energie, die der Arbeit entspricht, die das System verlässt. Die von der Turbine geleistete Arbeit ist gegeben durch W T = H 4 – H 3 . Auch hier bleibt die Entropie unverändert.
- Isobare Wärmeabgabe (in einem Wärmetauscher) – In dieser Phase wird der Zyklus durch einen Prozess mit konstantem Druck abgeschlossen, bei dem Wärme aus dem Gas abgegeben wird. Die Arbeitsgastemperatur sinkt von Punkt 4 auf Punkt 1. Die abgegebene Nettowärme ergibt sich aus Q re = H 4 – H 1
Während eines Brayton-Zyklus wird vom Kompressor zwischen den Zuständen 1 und 2 ( i sentropische Kompression ) am Gas gearbeitet . Die Arbeit wird durch das Gas in der Turbine zwischen den Stufen 3 und 4 erledigt ( i sentropische Expansion ). Die Differenz zwischen der vom Gas geleisteten Arbeit und der am Gas geleisteten Arbeit ist das vom Zyklus erzeugte Netz und entspricht der von der Zykluskurve eingeschlossenen Fläche (im pV-Diagramm).
Wie zu sehen ist, ist es zweckmäßig, bei der Analyse dieses thermodynamischen Zyklus die Enthalpie oder die spezifische Enthalpie zu verwenden und das erste Gesetz in Bezug auf die Enthalpie auszudrücken . Diese Form des Gesetzes vereinfacht die Beschreibung der Energieübertragung . Bei konstantem Druck entspricht die Enthalpieänderung der Energie , die durch Erhitzen aus der Umgebung übertragen wird:
Isobarer Prozess (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Bei konstanter Entropie , dh im isentropischen Prozess, entspricht die Enthalpieänderung der am oder vom System durchgeführten Flussprozessarbeit :
Isentropischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1
Siehe auch: Warum verwenden Energieingenieure Enthalpie? Antwort: dH = dQ + Vdp
Isentropischer Prozess
Ein isentropischer Prozess ist ein thermodynamischer Prozess , bei dem die Entropie des Fluids oder Gases konstant bleibt. Dies bedeutet, dass der isentrope Prozess ein Sonderfall eines adiabatischen Prozesses ist, bei dem keine Wärme- oder Materieübertragung stattfindet. Es ist ein reversibler adiabatischer Prozess . Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Näherung nur in sehr schnellen Prozessen verwenden können .
Isentropischer Prozess und das erste Gesetz
Für ein geschlossenes System können wir den ersten Hauptsatz der Thermodynamik in Bezug auf die Enthalpie schreiben :
dH = dQ + Vdp
oder
dH = TdS + Vdp
Isentropischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (für ideales Gas )
Isentropischer Prozess des idealen Gases
Der isentrope Prozess (ein Sonderfall des adiabatischen Prozesses) kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV κ = konstant
oder
p 1 V 1 κ = p 2 V 2 κ
wobei κ = c p / c v das Verhältnis der spezifischen Wärme (oder Wärmekapazitäten ) für das Gas ist. Eine für konstanten Druck (c p ) und eine für konstantes Volumen (c v ) . Es ist zu beachten, dass dieses Verhältnis κ = c p / c v ein Faktor bei der Bestimmung der Schallgeschwindigkeit in einem Gas und anderen adiabatischen Prozessen ist.
Isobarer Prozess
Ein isobarer Prozess ist ein thermodynamischer Prozess , bei dem der Druck des Systems konstant bleibt (p = const). Die Wärmeübertragung in oder aus dem System funktioniert zwar, verändert aber auch die innere Energie des Systems.
Da sich die innere Energie (dU) und das Systemvolumen (∆V) ändern, verwenden Ingenieure häufig die Enthalpie des Systems, die wie folgt definiert ist:
H = U + pV
Isobarer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit . Bei einem isobaren Prozess und dem idealen Gas wird ein Teil der dem System zugeführten Wärme für die Arbeit verwendet, und ein Teil der zugeführten Wärme erhöht die innere Energie (erhöht die Temperatur). Daher ist es zweckmäßig, die Enthalpie anstelle der inneren Energie zu verwenden.
Isobarer Prozess (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Bei konstanter Entropie , dh im isentropischen Prozess, entspricht die Enthalpieänderung der am oder vom System durchgeführten Flussprozessarbeit .
Isobarer Prozess des idealen Gases
Der isobare Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
oder
In einem pV-Diagramm erfolgt der Prozess entlang einer horizontalen Linie (Isobare genannt) mit der Gleichung p = Konstante.
Siehe auch: Charles ‘Gesetz
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.