Cycle de Rankine – Processus
Dans un cycle de Rankine idéal, le système exécutant le cycle subit une série de quatre processus: deux processus isentropiques (adiabatiques réversibles) alternés avec deux processus isobares.
Cycle de Rankine – Processus
-
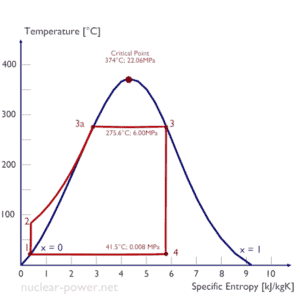
Cycle de Rankine – Diagramme Ts Compression isentropique (compression dans les pompes centrifuges) – Le condensat liquide est comprimé de manière adiabatique de l’état 1 à l’état 2 par des pompes centrifuges (généralement par des pompes à condensat, puis par des pompes d’alimentation). Le condensat liquide est pompé du condenseur dans la chaudière à pression supérieure. Dans ce processus, les environnements travaillent sur le fluide, en augmentant son enthalpie (h = u + pv) et en le comprimant (augmentant sa pression). Par contre, l’entropie reste inchangée. Le travail requis pour le compresseur est donné par W Pompes = H 2 – H 1 .
- Addition de chaleur isobare (dans un échangeur de chaleur – chaudière) – Dans cette phase (entre les états 2 et 3), il se produit un transfert de chaleur à pression constante vers le condensat liquide depuis une source externe, car la chambre est ouverte pour permettre des entrées et des sorties. . L’eau d’alimentation (circuit secondaire) est chauffée du point d’ébullition (2 → 3a) de ce fluide puis évaporée dans la chaudière (3a → 3). La chaleur nette ajoutée est donnée par Q add = H 3 – H 2
- Expansion isentropique (expansion dans une turbine à vapeur) – La vapeur de la chaudière se dilate de manière adiabatique de l’état 3 à l’état 4 dans une turbine à vapeur pour produire du travail, puis est rejetée dans le condenseur (partiellement condensée). La vapeur fonctionne sur les abords (aubes de la turbine) et perd une quantité d’enthalpie égale au travail qui quitte le système. Le travail effectué par turbine est donné par W T = H 4 – H 3 . Encore une fois, l’entropie reste inchangée.
- Rejet de chaleur isobare (dans un échangeur de chaleur) – Dans cette phase, le cycle se termine par un processus à pression constante dans lequel la chaleur est rejetée par la vapeur partiellement condensée. Il y a transfert de chaleur de la vapeur à l’eau de refroidissement circulant dans un circuit de refroidissement. La vapeur se condense et la température de l’eau de refroidissement augmente. La chaleur nette rejetée est donnée par Q re = H 4 – H 1
Au cours d’ un cycle de Rankine, le travail est effectué sur le fluide par les pompes entre les états 1 et 2 ( i sentropic compression ). Le travail se fait par le fluide dans la turbine entre les étapes 3 et 4 ( i sentropic extension ). La différence entre le travail effectué par le fluide et le travail effectué sur le fluide correspond au travail en réseau produit par le cycle et correspond à la surface délimitée par la courbe de cycle (dans le diagramme pV). Le fluide de travail dans un cycle de Rankine suit une boucle fermée et est réutilisé en permanence.
Comme on peut le constater, il est pratique d’utiliser l’enthalpie et le première principe en matière d’enthalpie dans l’analyse de ce cycle thermodynamique. Cette forme de loi simplifie la description du transfert d’énergie . À pression constante , le changement d’enthalpie est égal à l’ énergie transférée de l’environnement par le chauffage:
Processus isobare (Vdp = 0):
dH = dQ → Q = H 2 – H 1
A entropie constante , c’est-à-dire dans le processus isentropique, le changement d’enthalpie est égal au travail de traitement du flux effectué sur ou par le système:
Processus isentropique (dQ = 0):
dH = Vdp → W = H 2 – H 1
Voir aussi: Pourquoi les ingénieurs motoristes utilisent l’enthalpie? Réponse: dH = dQ + Vdp
Processus isentropique
Un processus isentropique est un processus thermodynamique , dans lequel l’ entropie du fluide ou du gaz reste constante. Cela signifie que le processus isentropique est un cas particulier d’un processus adiabatique dans lequel il n’y a pas de transfert de chaleur ou de matière. Il s’agit d’un processus adiabatique réversible . L’hypothèse d’absence de transfert de chaleur est très importante, car nous ne pouvons utiliser l’approximation adiabatique que dans des processus très rapides .
Processus isentropique et première loi
Pour un système fermé, on peut écrire la première loi de la thermodynamique en termes d’enthalpie :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processus isentropique (dQ = 0):
dH = Vdp → W = H 2 – H 1
Processus isobare
Un processus isobare est un processus thermodynamique , dans lequel la pression du système reste constante (p = const). Le transfert de chaleur dans ou hors du système fonctionne, mais modifie également l’énergie interne du système.
Puisqu’il y a des changements d’ énergie interne (dU) et des changements de volume du système (∆V), les ingénieurs utilisent souvent l’ enthalpie du système, qui est définie comme:
H = U + pV
Processus isobare et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites . Dans un procédé isobare et le gaz parfait, une partie de la chaleur ajoutée au système sera utilisée pour faire le travail et une partie de la chaleur ajoutée augmentera l’ énergie interne (augmentera la température). Par conséquent, il est commode d’utiliser l’ enthalpie au lieu de l’énergie interne.
Processus isobare (Vdp = 0):
dH = dQ → Q = H 2 – H 1
À entropie constante , c’est-à-dire dans un processus isentropique, le changement d’enthalpie est égal au travail de processus d’écoulement effectué sur ou par le système.
Cycle de Rankine – diagramme pV, Ts
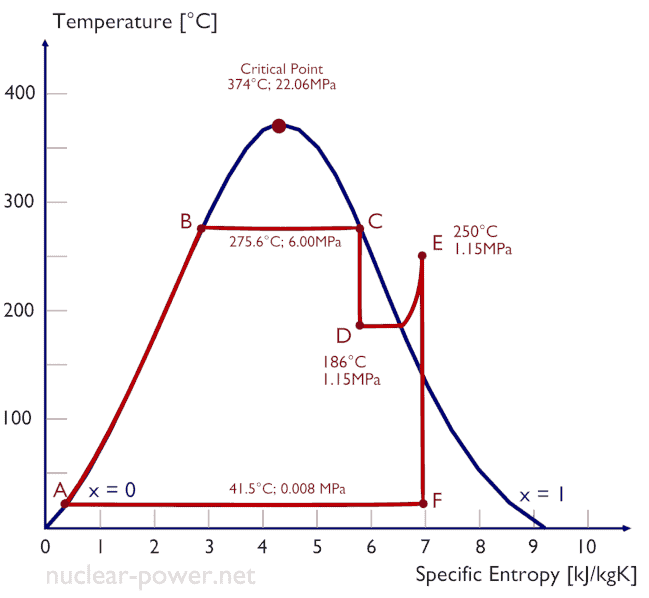
Le cycle de Rankine est souvent tracé sur un diagramme pression-volume (diagramme pV ) et sur un diagramme température-entropie ( diagramme Ts ).
Lorsqu’ils sont tracés sur un diagramme de volume de pression , les processus isobares suivent les lignes isobares pour le gaz (les lignes horizontales), les processus adiabatiques se déplacent entre ces lignes horizontales et la zone délimitée par la piste cyclable complète représente le travail total qui peut être effectué au cours d’une cycle.
Le diagramme température-entropie (diagramme Ts) dans laquelle l’état thermodynamique est défini par un point sur un graphique avec l’ entropie déterminée (s) en tant que l’axe horizontal et la température absolue (T) comme axe vertical. Les diagrammes Ts sont un outil utile et courant, notamment parce qu’il permet de visualiser le transfert de chaleur au cours d’un processus. Pour les processus réversibles (idéaux), l’aire sous la courbe Ts d’un processus est la chaleur transférée au système pendant ce processus.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci