Rankine-Zyklus – Prozesse
In einem idealen Rankine-Zyklus durchläuft das System, das den Zyklus ausführt, eine Reihe von vier Prozessen: Zwei isentrope (reversible adiabatische) Prozesse wechseln sich mit zwei isobaren Prozessen ab.
Rankine-Zyklus – Prozesse
-
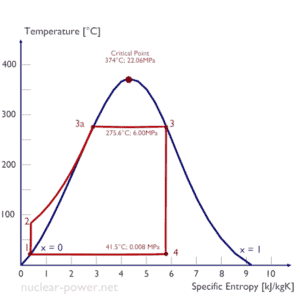
Rankine-Zyklus – Ts-Diagramm Isentropische Verdichtung (Verdichtung in Kreiselpumpen) – Das flüssige Kondensat wird von Kreiselpumpen (üblicherweise von Kondensatpumpen und anschließend von Speisewasserpumpen) adiabatisch von Zustand 1 nach Zustand 2 verdichtet. Die flüssige Kondensatdatei wird vom Kondensator in den Hochdruckkessel gepumpt. In diesem Prozess wirkt die Umgebung auf die Flüssigkeit ein, erhöht ihre Enthalpie (h = u + pv) und komprimiert sie (erhöht ihren Druck). Andererseits bleibt die Entropie unverändert. Die für den Kompressor erforderliche Arbeit ergibt sich aus W Pumpen = H 2 – H 1 .
- Isobare Wärmezugabe (in einem Wärmetauscher – Kessel) – In dieser Phase (zwischen Zustand 2 und Zustand 3) erfolgt eine druckkonstante Wärmeübertragung von einer externen Quelle auf das flüssige Kondensat, da die Kammer zum Ein- und Ausströmen geöffnet ist . Das Speisewasser (Sekundärkreislauf) wird bis zum Siedepunkt (2 → 3a) dieser Flüssigkeit erhitzt und dann im Kessel (3a → 3) verdampft. Die hinzugefügte Nettowärme ergibt sich aus Q add = H 3 – H 2
- Isentropenexpansion (Expansion in einer Dampfturbine) – Dampf aus dem Kessel expandiert adiabatisch von Zustand 3 nach Zustand 4 in einer Dampfturbine, um Arbeit zu erzeugen, und wird dann in den Kondensator abgegeben (teilweise kondensiert). Der Dampf wirkt auf die Umgebung (Schaufeln der Turbine) und verliert eine Enthalpie, die der Arbeit entspricht, die das System verlässt. Die von der Turbine geleistete Arbeit ergibt sich aus W T = H 4 – H 3 . Auch hier bleibt die Entropie unverändert.
- Isobare Wärmeabgabe (in einem Wärmetauscher) – In dieser Phase wird der Kreislauf durch einen Prozess mit konstantem Druck abgeschlossen, bei dem die Wärme aus dem teilweise kondensierten Dampf abgeleitet wird. In einem Kühlkreislauf wird Wärme vom Dampf auf das Kühlwasser übertragen. Der Dampf kondensiert und die Temperatur des Kühlwassers steigt an. Die abgegebene Nettowärme ergibt sich aus Q re = H 4 – H 1
Während eines Rankine-Zyklus wird von den Pumpen zwischen Zustand 1 und 2 ( i sentropische Kompression ) an der Flüssigkeit gearbeitet . Die Arbeit wird von der Flüssigkeit in der Turbine zwischen den Stufen 3 und 4 erledigt ( i sentrope Expansion ). Der Unterschied zwischen der von der Flüssigkeit geleisteten Arbeit und der an der Flüssigkeit geleisteten Arbeit ist das vom Zyklus erzeugte Netz und entspricht der von der Zykluskurve umschlossenen Fläche (in pV-Diagramm). Das Arbeitsfluid in einem Rankine-Kreislauf folgt einem geschlossenen Kreislauf und wird ständig wiederverwendet.
Es ist ersichtlich, dass es zweckmäßig ist, die Enthalpie und das erste Gesetz in Bezug auf die Enthalpie bei der Analyse dieses thermodynamischen Zyklus zu verwenden. Diese Gesetzesform vereinfacht die Beschreibung der Energieübertragung . Bei konstantem Druck entspricht die Enthalpieänderung der Energie , die durch Erhitzen aus der Umgebung übertragen wird:
Isobarer Prozess (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Bei konstanter Entropie , dh im isentropischen Prozess, entspricht die Enthalpieänderung der am oder vom System durchgeführten Flussprozessarbeit :
Isentropischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1
Siehe auch: Warum verwenden Energieingenieure Enthalpie? Antwort: dH = dQ + Vdp
Isentropischer Prozess
Ein isentropischer Prozess ist ein thermodynamischer Prozess , bei dem die Entropie des Fluids oder Gases konstant bleibt. Dies bedeutet, dass der isentrope Prozess ein Sonderfall eines adiabatischen Prozesses ist, bei dem keine Wärme- oder Materieübertragung stattfindet. Es ist ein reversibler adiabatischer Prozess . Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Näherung nur in sehr schnellen Prozessen verwenden können .
Isentropischer Prozess und das erste Gesetz
Für ein geschlossenes System können wir den ersten Hauptsatz der Thermodynamik in Bezug auf die Enthalpie schreiben :
dH = dQ + Vdp
oder
dH = TdS + Vdp
Isentropischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1
Isobarer Prozess
Ein isobarer Prozess ist ein thermodynamischer Prozess , bei dem der Druck des Systems konstant bleibt (p = const). Die Wärmeübertragung in oder aus dem System funktioniert zwar, verändert aber auch die innere Energie des Systems.
Da sich die innere Energie (dU) und das Systemvolumen (∆V) ändern, verwenden Ingenieure häufig die Enthalpie des Systems, die wie folgt definiert ist:
H = U + pV
Isobarer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit . Bei einem isobaren Prozess und dem idealen Gas wird ein Teil der dem System zugeführten Wärme für die Arbeit verwendet, und ein Teil der zugeführten Wärme erhöht die innere Energie (erhöht die Temperatur). Daher ist es zweckmäßig, die Enthalpie anstelle der inneren Energie zu verwenden.
Isobarer Prozess (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Bei konstanter Entropie , dh im isentropischen Prozess, entspricht die Enthalpieänderung der am oder vom System durchgeführten Flussprozessarbeit .
Rankine-Zyklus – pV, Ts-Diagramm
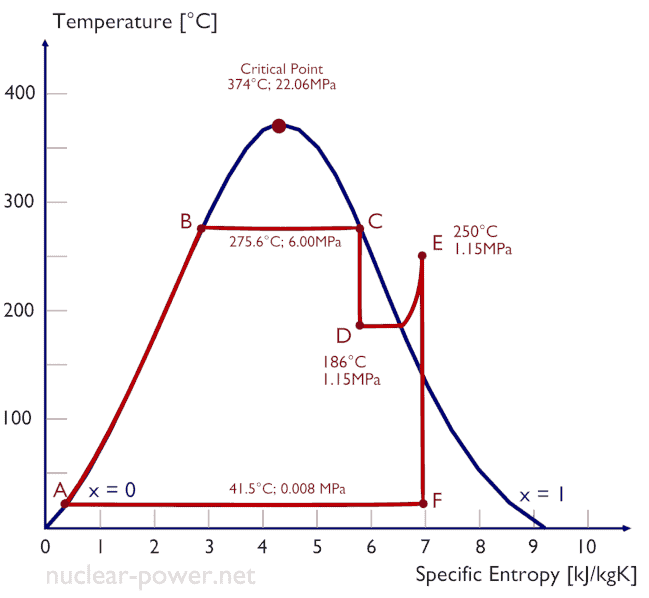
Der Rankine-Zyklus wird häufig in einem Druckvolumendiagramm ( pV-Diagramm ) und in einem Temperatur-Entropie-Diagramm ( Ts-Diagramm ) aufgezeichnet .
Wenn sie auf einem aufgetragen P-V-Diagramm , die isobare Verfahren der isobare Leitungen für das Gas (die horizontalen Linien) folgen, adiabatische Prozesse zwischen diesen horizontalen Linien bewegen , und die durch den gesamten Zyklus hinweg Pfad begrenzt Bereich stellt die gesamte Arbeit , die während einem getan werden kann , Zyklus.
Das Temperatur-Entropie-Diagramm (Ts-Diagramm), in dem der thermodynamische Zustand durch einen Punkt in einem Diagramm mit spezifischen Entropien als horizontale Achse und absoluter Temperatur (T) als vertikaler Achse angegeben wird. Ts-Diagramme sind ein nützliches und allgemeines Werkzeug, insbesondere weil sie dazu beitragen, die Wärmeübertragung während eines Prozesses zu visualisieren . Bei reversiblen (idealen) Prozessen ist die Fläche unter der Ts-Kurve eines Prozesses die Wärme , die während dieses Prozesses auf das System übertragen wird.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.