Ciclos termodinámicos
En general, la termodinámica es la ciencia que se ocupa de la producción, almacenamiento, transferencia y conversión de energía. Nuestro objetivo aquí será introducir la termodinámica como la ciencia de conversión de energía . En la actualidad, el combustible fósil sigue siendo la fuente de energía predominante del mundo. Pero la quema de combustibles fósiles genera solo energía térmica , por lo tanto, estas fuentes de energía se denominan ” fuentes de energía primaria “, que deben convertirse en fuente de energía secundaria , los llamados portadores de energía ( energía eléctrica, etc.). Para convertir la energía térmica en otra forma de energía , se debe utilizar un motor térmico .
Muchos motores térmicos funcionan de manera cíclica , agregando energía en forma de calor en una parte del ciclo y utilizando esa energía para realizar un trabajo útil en otra parte del ciclo.
Un proceso que finalmente devuelve un sistema a su estado inicial se denomina proceso cíclico . Al final de un ciclo, todas las propiedades tienen el mismo valor que tenían al principio. El ciclo termodinámico típico consiste en una serie de procesos termodinámicos que transfieren calor y trabajo, al tiempo que varían la presión, la temperatura y otras variables de estado, y finalmente devuelven un sistema a su estado inicial.
La primera ley de la termodinámica dicta que la entrada neta de calor es igual a la salida neta de trabajo durante cualquier ciclo.
El aumento de la energía interna de un sistema cerrado es igual al calor suministrado al sistema menos el trabajo realizado por él.
IntE int = Q – W
Esta es la primera ley de la termodinámica y es el principio de conservación de la energía , lo que significa que la energía puede ser creada ni destruida , sino más bien transforma en diversas formas como se está estudiando el fluido dentro del volumen de control.
Es la ley más importante para el análisis de la mayoría de los sistemas y la que cuantifica cómo se transforma la energía térmica en otras formas de energía .
Los ciclos termodinámicos se pueden dividir en dos clases principales:
- Ciclos de potencia. Los ciclos de potencia son ciclos que convierten cierta entrada de calor en una salida de trabajo mecánico . Los ciclos de potencia termodinámica son la base para el funcionamiento de los motores térmicos, que ejecutan la gran mayoría de los vehículos de motor y generan la mayor parte de la energía eléctrica del mundo.
- Ciclos de bomba de calor. Ciclos de bomba de calor transfieren calor desde bajas a altas temperaturas utilizando trabajo mecánico de entrada. No hay diferencia entre la termodinámica de los refrigeradores y las bombas de calor. Ambos funcionan moviendo el calor de un espacio frío a un espacio cálido.
-
La siguiente clasificación de ciclos termodinámicos se realiza de acuerdo con sus procesos termodinámicos constituyentes. En la práctica, los ciclos termodinámicos idealizados simples generalmente se componen de cuatro procesos termodinámicos. En general, los siguientes procesos suelen constituir ciclos termodinámicos:
Ciclo de Carnot
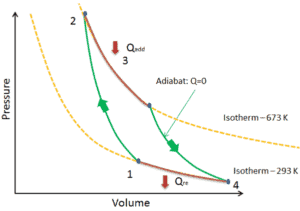
Diagrama pV del ciclo de Carnot. El área delimitada por la ruta completa del ciclo representa el trabajo total que se puede hacer durante un ciclo. Ver también: ciclo de Carnot
En 1824, un ingeniero y físico francés, Nicolas Léonard Sadi Carnot avanzó el estudio de la segunda ley al formar un principio (también llamado la regla de Carnot ) que especifica los límites de la máxima eficiencia que cualquier motor térmico puede obtener. En resumen, este principio establece que la eficiencia de un ciclo termodinámico depende únicamente de la diferencia entre los depósitos de temperatura caliente y fría.
El principio de Carnot establece:
- Ningún motor puede ser más eficiente que un motor reversible ( un motor térmico de Carnot ) que opera entre los mismos depósitos de alta temperatura y baja temperatura.
- Las eficiencias de todos los motores reversibles (motores de calor Carnot ) que funcionan entre los mismos depósitos de temperatura constante son los mismos, independientemente de la sustancia de trabajo empleada o los detalles de operación.
El ciclo de este motor se llama ciclo de Carnot . Un sistema que experimenta un ciclo de Carnot se llama motor de calor de Carnot . No es un ciclo termodinámico real, pero es una construcción teórica y no se puede construir en la práctica. Todos los procesos termodinámicos reales son de alguna manera irreversibles . No se realizan de manera infinitamente lenta e infinitamente pequeños pasos de temperatura también son una ficción teórica. Por lo tanto, los motores térmicos deben tener eficiencias más bajas que los límites en su eficiencia debido a la irreversibilidad inherente del ciclo del motor térmico que usan.
Ciclo Otto
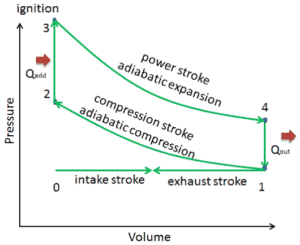
Diagrama pV del ciclo Otto. El área delimitada por la ruta completa del ciclo representa el trabajo total que se puede hacer durante un ciclo. Ver también: ciclo Otto
Ver también: ciclo de Atkinson
El ciclo del motor Otto se llama ciclo Otto . Es uno de los ciclos termodinámicos más comunes que se pueden encontrar en los motores de automóviles y describe el funcionamiento de un motor de pistón de encendido por chispa típico. A diferencia del ciclo de Carnot, el ciclo de Otto no ejecuta procesos isotérmicos, ya que estos deben realizarse muy lentamente. En un ciclo Otto ideal, el sistema que ejecuta el ciclo se somete a una serie de cuatro procesos reversibles internamente: dos procesos isentrópicos (adiabáticos reversibles) alternados con dos procesos isocróricos.
Dado que el principio de Carnot establece que ningún motor puede ser más eficiente que un motor reversible ( un motor térmico de Carnot ) que opera entre los mismos depósitos de alta temperatura y baja temperatura, el motor Otto debe tener una eficiencia menor que la eficiencia de Carnot. Un motor automotriz de gasolina típico opera alrededor del 25% al 30% de la eficiencia térmica. Aproximadamente 70-75% se rechaza como calor residual sin convertirse en trabajo útil, es decir, trabajo entregado a las ruedas.
Ciclo diesel
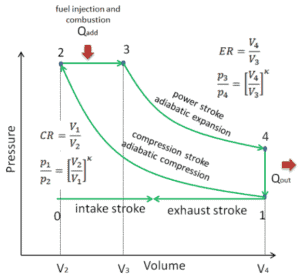
Ciclo diésel – diagrama pV Ver también: ciclo diesel
Ver también: doble ciclo
El ciclo diesel es uno de los ciclos termodinámicos más comunesque se pueden encontrar en los motores de automóviles y describe el funcionamiento de un motor de pistón de encendido por compresión típico. El motor Diesel es similar en operación al motor de gasolina. La diferencia más importante es que:
- No hay combustible en el cilindro al comienzo de la carrera de compresión, por lo tanto, no se produce una autoignición en los motores Diesel.
- El motor diesel usa encendido por compresión en lugar de encendido por chispa.
- Debido a la alta temperatura desarrollada durante la compresión adiabática, el combustible se enciende espontáneamente a medida que se inyecta. Por lo tanto, no se necesitan bujías.
- Antes del comienzo de la carrera de potencia, los inyectores comienzan a inyectar combustible directamente en la cámara de combustión y, por lo tanto, la primera parte de la carrera de potencia se produce aproximadamente a la presión constante.
- Se pueden lograr relaciones de compresión más altas en motores Diesel que en motores Otto
Ciclo Brayton
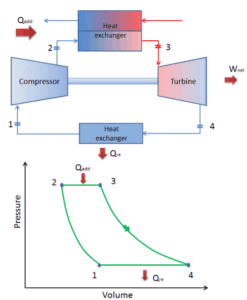
ciclo cerrado de Brayton Ver también: ciclo de Brayton
Ver también: ciclo de Ericsson
En 1872, un ingeniero estadounidense, George Bailey Brayton, avanzó el estudio de los motores térmicos patentando un motor de combustión interna a presión constante, que inicialmente usaba gas vaporizado pero luego usaba combustibles líquidos como el queroseno. Este motor térmico se conoce como ” Motor Listo de Brayton “ . Significa que el motor Brayton original usaba un compresor de pistón y un expansor de pistón en lugar de una turbina de gas y un compresor de gas.
Hoy en día, los modernos motores de turbina de gas y los motores de inyección de aire también son motores de calor de presión constante, por lo tanto, describimos su termodinámica por el ciclo Brayton . En general, el ciclo de Brayton describe el funcionamiento de un motor térmico de presión constante .
Es uno de los ciclos termodinámicos más comunes que se pueden encontrar en las centrales eléctricas de turbinas de gas o en aviones. A diferencia del ciclo de Carnot , el ciclo de Brayton no ejecuta procesos isotérmicos , ya que estos deben realizarse muy lentamente. En un ciclo Brayton ideal , el sistema que ejecuta el ciclo se somete a una serie de cuatro procesos: dos procesos isentrópicos (adiabáticos reversibles) alternados con dos procesos isobáricos.
Ciclo Rankine
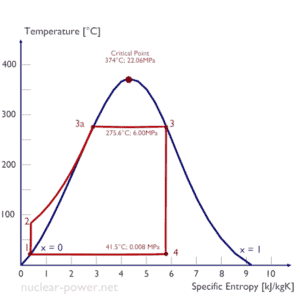
Ciclo Rankine – Diagrama Ts Ver también: ciclo de Rankine
En 1859, un ingeniero escocés, William John Macquorn Rankine, avanzó en el estudio de los motores térmicos al publicar el ” Manual del motor de vapor y otros motores principales “. Rankine desarrolló una teoría completa de la máquina de vapor y, de hecho, de todas las máquinas de calor. Junto con Rudolf Clausius y William Thomson (Lord Kelvin), contribuyó a la termodinámica, centrándose particularmente en la primera de las tres leyes termodinámicas. El ciclo de Rankine lleva su nombre y describe el rendimiento de los sistemas de turbinas de vapor , aunque la teoría El principio también se aplica a los motores alternativos, como las locomotoras de vapor. En general, el ciclo de Rankinees un ciclo termodinámico idealizado de un motor térmico de presión constante que convierte parte del calor en trabajo mecánico. En este ciclo, el calor se suministra externamente a un circuito cerrado, que generalmente usa agua (en fase líquida y de vapor) como fluido de trabajo. En contraste con el ciclo de Brayton , el fluido de trabajo en el ciclo de Rankine experimenta el cambio de fase de una fase líquida a una de vapor y viceversa.
Si bien muchas sustancias podrían usarse como fluido de trabajo en el ciclo de Rankine (inorgánico o incluso orgánico), el agua suele ser el fluido de elección debido a sus propiedades favorables, como su química no tóxica y no reactiva, abundancia y bajo costo, así como sus propiedades termodinámicas. Por ejemplo, el agua tiene el calor específico más alto de cualquier sustancia común: 4,19 kJ / kg K. Además, tiene un calor de vaporización muy alto , lo que lo convierte en un refrigerante y medio efectivo en centrales térmicas y otras industrias energéticas. En el caso del ciclo de Rankine, la Ley del Gas Idealcasi no se puede usar (el vapor no sigue pV = nRT), por lo tanto, todos los parámetros importantes de agua y vapor se tabulan en las llamadas ” Tablas de vapor “.
Una de las principales ventajas del ciclo Rankine es que el proceso de compresión en la bomba tiene lugar en un líquido . Al condensar el vapor de trabajo en un líquido (dentro de un condensador), la presión en la salida de la turbina se reduce y la energía requerida por la bomba de alimentación consume solo del 1% al 3% de la potencia de salida de la turbina y estos factores contribuyen a una mayor eficiencia para el ciclo.
Hoy, el ciclo de Rankine es el ciclo operativo fundamental de todas las centrales térmicas donde un fluido operativo se evapora y condensa continuamente. Es uno de los ciclos termodinámicos más comunes , porque en la mayoría de los lugares del mundo la turbina funciona con vapor.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.