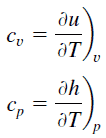Modelo de gas ideal
El modelo de gas ideal se usa para predecir el comportamiento de los gases y es uno de los modelos de sustancias más útiles y comúnmente utilizados jamás desarrollados. Se descubrió que si confinamos muestras de 1 mol de varios gases en un volumen idéntico y mantenemos los gases a la misma temperatura , entonces sus presiones medidas son casi las mismas . Además, cuando confinamos gases a densidades más bajas, las diferencias tienden a desaparecer. Se descubrió que tales gases tienden a obedecer la siguiente relación, que se conoce como la ley de los gases ideales :
pV = nRT
dónde:
p es la presión absoluta del gas
n es la cantidad de sustancia
T es la temperatura absoluta
Ves el volumen
R es la constante de gas ideal, o universal,igual al producto de la constante de Boltzmann y la constante de Avogadro. El poder de la ley del gas ideal está en su simplicidad. Cuandose dandos de las variables termodinámicas , p, v y T, se puede encontrar fácilmente la tercera.
El modelo de gas ideal se basa en los siguientes supuestos:
- La presión, el volumen y la temperatura de un gas ideal obedecen la ley del gas ideal .
- La energía interna específica es solo una función de la temperatura: u = u (T)
- La masa molar de un gas ideal es idéntica a la masa molar de la sustancia real.
- Los calores específicos – c p y c v – son independientes de la temperatura, lo que significa que son constantes.
Desde el punto de vista microscópico se basa en estos supuestos:
- Las moléculas del gas son esferas pequeñas y duras .
- Las únicas fuerzas entre las moléculas de gas son aquellas que determinan las colisiones puntuales .
- Todas las colisiones son elásticas y todo movimiento es sin fricción .
- La distancia promedio entre las moléculas es mucho mayor que el tamaño de las moléculas.
- Las moléculas se mueven en direcciones aleatorias.
- No hay otra fuerza atractiva o repulsiva entre estas moléculas.
¿Qué es un gas ideal?
Un gas ideal se define como aquel en el que todas las colisiones entre átomos o moléculas son perfectamente elásticas y en el que no hay fuerzas de atracción intermoleculares . Un gas ideal puede visualizarse como una colección de esferas perfectamente duras que chocan pero que, de lo contrario, no interactúan entre sí. En realidad, ningún gas real es como un gas ideal y, por lo tanto, ningún gas real sigue completamente la ley o ecuación del gas ideal . A temperaturas cercanas al punto de ebullición de los gases , aumenta la presión.provocará la condensación y una disminución drástica del volumen. A presiones muy altas, las fuerzas intermoleculares de un gas son significativas. Sin embargo, la mayoría de los gases están en acuerdo aproximado a presiones y temperaturas superiores a su punto de ebullición. Los ingenieros que trabajan con gases utilizan la ley de los gases ideales porque es simple de usar y se aproxima al comportamiento real de los gases.
Segunda ley de Joule
Para cualquier gas cuya ecuación de estado esté dada exactamente por pV = nRT (o pv = RT ), la energía interna específica depende solo de la temperatura. Esta regla fue encontrada originalmente en 1843 por un físico inglés James Prescott Joule experimentalmente para gases reales y se conoce como la segunda ley de Joule :
La energía interna de una masa fija de un gas ideal depende solo de su temperatura (no de presión o volumen).
La entalpía específica de un gas descrita por pV = nRT también depende solo de la temperatura. Tenga en cuenta que la entalpía es la cantidad termodinámica equivalente al contenido de calor total de un sistema. Es igual a la energía interna del sistema más el producto de presión y volumen. Por lo tanto, en variables intensivas, la segunda ley de Joule viene dada por h = h (T) = u (T) + pv = u (T) + RT.
Estas tres ecuaciones constituyen el modelo de gas ideal, resumido de la siguiente manera:
pv = RT
u = u (T)
h = h (T) = u (T) + RT
Ley de gas ideal
Cualquier ecuación que relacione la presión, la temperatura y el volumen específico de una sustancia se llama ecuación de estado . La ecuación de estado más simple y mejor conocida para las sustancias en la fase gaseosa es la ecuación de estado del gas ideal . Émile Clapeyron lo declaró por primera vez en 1834 como una combinación de la ley empírica de Boyle, la ley de Charles y la ley de Avogadro. Esta ecuación predice el comportamiento pvT de un gas con bastante precisión para gases diluidos o de baja presión. En un gas ideal, las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales, la presión varía linealmente con la temperatura y la cantidad , e inversamente con el volumen .
pV = nRT
dónde:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal o universal,igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
El poder de la ley del gas ideal está en su simplicidad . Cuando se dan dos de las variables termodinámicas, p, v y T , se puede encontrar fácilmente la tercera . Muchas condiciones físicas de gases calculadas por los ingenieros se ajustan a la descripción anterior. Quizás el uso más común del comportamiento del gas estudiado por los ingenieros es el del proceso de compresión y el proceso de expansión utilizando aproximaciones de gas ideales.
Leyes de gas
En general, las leyes de gases son las primeras ecuaciones de estado , que correlacionan las densidades de gases y líquidos con las temperaturas y presiones. Las leyes de los gases se desarrollaron por completo a fines del siglo XVIII. Estas leyes o declaraciones precedieron a la ley del gas ideal , ya que individualmente estas leyes se consideran casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes. Como han sido reemplazados casi por completo por la ecuación de gas ideal, no es habitual que los estudiantes aprendan estas leyes en detalle. La ecuación del gas ideal fue establecida por primera vez por Émile Clapeyron en 1834 como una combinación de estas leyes:
Ejemplo: Ley de gas ideal: compresión de gas dentro de un presurizador
La presión en el circuito primario de los PWR se mantiene mediante un presurizador , un recipiente separado que está conectado al circuito primario (pata caliente) y se llena parcialmente con agua que se calienta a la temperatura de saturación (punto de ebullición) para la presión deseada mediante un sistema eléctrico sumergido. calentadores . Durante el calentamiento de la planta, el presurizador se puede llenar con nitrógeno en lugar de vapor saturado .
Suponga que un presurizador contiene 12 m 3 de nitrógeno a 20 ° C y 15 bar . La temperatura se eleva a 35 ° C y el volumen se reduce a 8,5 m 3 . ¿Cuál es la presión final del gas dentro del presurizador? Suponga que el gas es ideal.
Solución:
Como el gas es ideal, podemos usar la ley del gas ideal para relacionar sus parámetros, tanto en el estado inicial i como en el estado final f . Por lo tanto:
p init V init = nRT init
y
p final V final = nRT final
Dividiendo la segunda ecuación por la primera ecuación y resolviendo para p f obtenemos:
p final = p init T final V init / T init V final
Tenga en cuenta que no podemos convertir las unidades de volumen y presión en unidades SI básicas, porque se cancelan entre sí. Por otro lado, tenemos que usar Kelvins en lugar de grados Celsius. Por lo tanto, T init = 293 K y T final = 308 K.
A continuación, la presión resultante en el estado final será:
p final = (15 bar) x (308 K) x (12 m 3 ) / (293 K) x (8.5 m 3 ) = 22 bar
Validez de la Ley del Gas Ideal
Dado que el gas ideal se define como uno en el que todas las colisiones entre átomos o moléculas son perfectamente elásticas y en el que no existen fuerzas de atracción intermoleculares, en la naturaleza no existe un gas realmente ideal. Por otro lado, todos los gases reales se acercan al estado ideal a bajas presiones (densidades) . A bajas presiones, las moléculas están lo suficientemente separadas como para que no interactúen entre sí.
En otras palabras, la Ley del Gas Ideal es precisa solo a presiones relativamente bajas (en relación con la presión crítica p cr ) y altas temperaturas (en relación con la temperatura crítica T cr ). En estos parámetros, el factor de compresibilidad, Z = pv / RT , es aproximadamente 1 . El factor de compresibilidad se usa para explicar la desviación de la situación ideal. Este factor de corrección depende de la presión y la temperatura de cada gas considerado.
Energía interna de un gas ideal
La energía interna es el total de toda la energía asociada con el movimiento de los átomos o moléculas en el sistema. Las formas microscópicas de energía incluyen aquellas debidas a la rotación , vibración , traslación e interacciones entre las moléculas de una sustancia.
Gas monoatómico – Energía interna
Para un gas ideal monoatómico (como helio, neón o argón), la única contribución a la energía proviene de la energía cinética traslacional . La energía cinética traslacional promedio de un solo átomo depende solo de la temperatura del gas y está dada por la ecuación:
K promedio = 3/2 kT.
La energía interna de n moles de un gas monoatómico ideal (un átomo por molécula) es igual a la energía cinética promedio por molécula multiplicada por el número total de moléculas, N:
E int = 3/2 NkT = 3/2 nRT
donde n es el número de moles. Cada dirección (x, y y z) contribuye (1/2) nRT a la energía interna . Aquí es donde entra en juego la idea de equipartición de energía : cualquier otra contribución a la energía también debe contribuir (1/2) nRT . Como se puede ver, la energía interna de un gas ideal depende solo de la temperatura y la cantidad de moles de gas.
Molécula Diatómica – Energía Interna
Si las moléculas de gas contienen más de un átomo, hay tres direcciones de traslación , y la energía cinética rotacional también contribuye, pero solo para rotaciones alrededor de dos de los tres ejes perpendiculares. Las cinco contribuciones a la energía (cinco grados de libertad) dan:
Gas ideal diatómico:
E int = 5/2 NkT = 5/2 nRT
Esto es solo una aproximación y se aplica a temperaturas intermedias. A bajas temperaturas solo contribuye la energía cinética traslacional , y a temperaturas más altas dos vibraciones aportan dos contribuciones adicionales (energía cinética y potencial). La energía interna será mayor a una temperatura dada que para un gas monoatómico, pero seguirá siendo función solo de la temperatura para un gas ideal.
La energía interna de los gases reales también depende principalmente de la temperatura, pero de manera similar a la Ley del Gas Ideal , la energía interna de los gases reales también depende en cierta medida de la presión y el volumen . Todos los gases reales se aproximan al estado ideal a bajas presiones (densidades). A bajas presiones, las moléculas están lo suficientemente separadas como para que no interactúen entre sí. La energía interna de líquidos y sólidos es bastante complicada, ya que incluye la energía potencial eléctrica asociada con las fuerzas (o enlaces químicos ) entre átomos y moléculas.
Calor específico a volumen constante y presión constante
El calor específico es una propiedad relacionada con la energía interna que es muy importante en termodinámica. Las propiedades intensivas c v y c p se definen para sustancias compresibles puras y simples como derivadas parciales de la energía interna u (T, v) y entalpía h (T, p) , respectivamente:
donde los subíndices v y p denotan las variables mantenidas fijas durante la diferenciación. Las propiedades c v y c p se denominan calores específicos (o capacidades de calor ) porque en ciertas condiciones especiales relacionan el cambio de temperatura de un sistema con la cantidad de energía agregada por transferencia de calor. Sus unidades SI son J / kg K o J / mol K . Se definen dos calores específicos para gases, uno para volumen constante (c v ) y otro para presión constante (c p ) .
 Según la primera ley de la termodinámica , para un proceso de volumen constante con un gas ideal monoatómico, el calor específico molar será:
Según la primera ley de la termodinámica , para un proceso de volumen constante con un gas ideal monoatómico, el calor específico molar será:
C v = 3 / 2R = 12.5 J / mol K
porque
U = 3 / 2nRT
Se puede deducir que el calor específico molar a presión constante es:
C p = C v + R = 5 / 2R = 20.8 J / mol K
Este C p es mayor que el calor específico molar a volumen constante C v , porque ahora se debe suministrar energía no solo para elevar la temperatura del gas sino también para que el gas funcione porque en este caso el volumen cambia.
La relación de Mayer: fórmula de Mayer
Julius Robert Mayer, químico y físico alemán, dedujo una relación entre el calor específico a presión constante y el calor específico a volumen constante para un gas ideal. Estudió el hecho de que la capacidad calorífica específica de un gas a presión constante (C p ) es ligeramente mayor que a volumen constante (C v ). Él razonó que este C p es mayor que el calor específico molar a volumen constante C v , porque ahora se debe suministrar energía no solo para elevar la temperatura del gas sino también para que el gas funcione porque en este caso el volumen cambia. De acuerdo con laLa relación de Mayer o la fórmula de Mayer, la diferencia entre estas dos capacidades de calor es igual a la constante de gas universal, por lo tanto, el calor específico molar a presión constante es igual:
C p = C v + R
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.