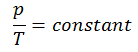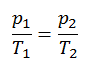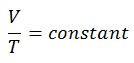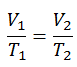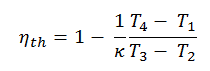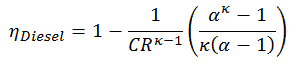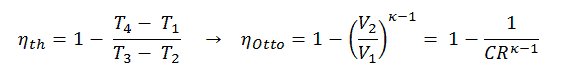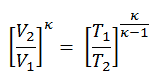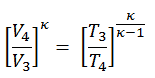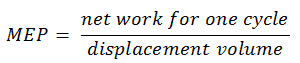Diesel Cycle – Dieselmotor
In den 1890er Jahren hat der deutsche Erfinder Rudolf Diesel seine Erfindung eines effizienten, langsam brennenden Verbrennungsmotors mit Selbstzündung patentieren lassen. Der von Rudolf Diesel vorgeschlagene ursprüngliche Zyklus war ein Zyklus mit konstanter Temperatur. In späteren Jahren erkannte Diesel, dass sein ursprünglicher Zyklus nicht funktionieren würde und er übernahm den konstanten Druckzyklus, der als Dieselzyklus bekannt ist .
Der Dieselzyklus ist einer der häufigsten thermodynamischen Kreisprozessen in Kraftfahrzeugmotoren und beschreibt die Funktionsweise eines typischen Kolbenmotors mit Selbstzündung. Der Dieselmotor arbeitet ähnlich wie der Benziner. Der wichtigste Unterschied ist, dass:
- Zu Beginn des Kompressionshubs befindet sich kein Kraftstoff im Zylinder, daher tritt bei Dieselmotoren keine Selbstentzündung auf.
- Der Dieselmotor verwendet eine Selbstzündung anstelle einer Funkenzündung.
- Aufgrund der hohen Temperatur, die während der adiabatischen Kompression entsteht, entzündet sich der Kraftstoff beim Einspritzen spontan. Daher werden keine Zündkerzen benötigt.
- Vor dem Beginn des Arbeitstakts beginnen die Einspritzdüsen, Kraftstoff direkt in den Brennraum einzuspritzen, und daher erfolgt der erste Teil des Arbeitstakts ungefähr bei konstantem Druck.
- Bei Dieselmotoren können höhere Verdichtungsverhältnisse erreicht werden als bei Ottomotoren
Dieselzyklus – Prozesse
In einem idealen Dieselzyklus durchläuft das System, das den Zyklus ausführt, eine Reihe von vier Prozessen: zwei isentrope (reversible adiabatische) Prozesse, die sich mit einem isochoren Prozess und einem isobaren Prozess abwechseln.
-
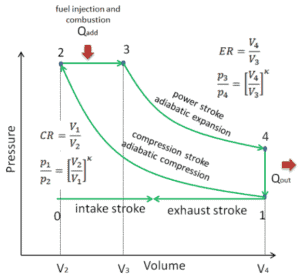
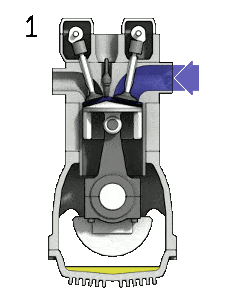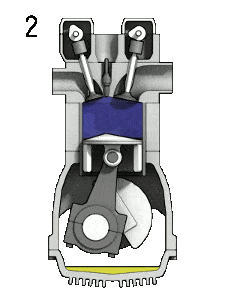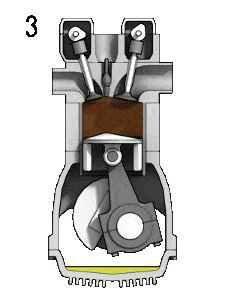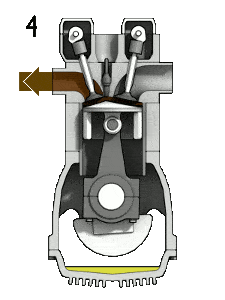
pV-Diagramm eines idealen Dieselzyklus Isentropische Kompression (Kompressionshub) – Die Luft wird adiabatisch von Zustand 1 nach Zustand 2 komprimiert, wenn sich der Kolben vom unteren Totpunkt zum oberen Totpunkt bewegt. Die Umgebung arbeitet am Gas, erhöht seine innere Energie (Temperatur) und komprimiert es. Andererseits bleibt die Entropie unverändert. Die Volumenänderungen und ihr Verhältnis ( V 1 / V 2 ) werden als Kompressionsverhältnis bezeichnet.
- Isobare Expansion (Zündphase) – In dieser Phase (zwischen Zustand 2 und Zustand 3) erfolgt eine Wärmeübertragung von einer externen Quelle (Verbrennung von eingespritztem Kraftstoff) an die Luft mit konstantem Druck (idealisiertes Modell), während sich der Kolben in Richtung bewegt V 3 . Während des Konstantdruckprozesses tritt Energie in das System ein, wenn Wärme Q hinzugefügt wird , und ein Teil der Arbeit wird durch Bewegen des Kolbens erledigt.
- Isentropische Expansion (Krafthub) – Das Gas expandiert adiabatisch von Zustand 3 zu Zustand 4, wenn sich der Kolben von V 3 zum unteren Totpunkt bewegt . Das Gas wirkt auf die Umgebung (Kolben) und verliert eine Menge an interner Energie, die der Arbeit entspricht, die das System verlässt. Auch hier bleibt die Entropie unverändert. Das Volumenverhältnis ( V 4 / V 3 ) ist als isentropes Expansionsverhältnis bekannt.
- Isochore Dekompression (Abgashub) – In dieser Phase wird der Zyklus durch einen Prozess mit konstantem Volumen abgeschlossen, bei dem der Luft Wärme entzogen wird, während sich der Kolben im unteren Totpunkt befindet. Der Arbeitsgasdruck fällt augenblicklich von Punkt 4 auf Punkt 1 ab. Das Auslassventil öffnet bei Punkt 4. Der Auslasshub erfolgt unmittelbar nach dieser Dekompression. Wenn sich der Kolben bei geöffnetem Auslassventil vom unteren Totpunkt (Punkt 1) zum oberen Totpunkt (Punkt 0) bewegt, wird das Gasgemisch in die Atmosphäre abgelassen und der Prozess beginnt von neuem.
Während des Dieselzyklus wird vom Gas zwischen den Zuständen 1 und 2 ( i sentropische Kompression ) am Gas gearbeitet . Die Arbeit am Kolben erfolgt zwischen den Stufen 2 und 3 ( i sobarische Wärmezufuhr ) und zwischen den Stufen 2 und 3 ( i sentropische Expansion ). Der Unterschied zwischen der vom Gas geleisteten Arbeit und der am Gas geleisteten Arbeit ist das vom Kreislauf erzeugte Netz und entspricht der von der Kreislaufkurve umschlossenen Fläche. Die durch die Zykluszeiten erzeugte Arbeit multipliziert mit der Geschwindigkeit des Zyklus (Kreisprozessen pro Sekunde) entspricht der vom Dieselmotor erzeugten Leistung.
Isentropischer Prozess
Ein isentropischer Prozess ist ein thermodynamischer Prozess , bei dem die Entropie des Fluids oder Gases konstant bleibt. Dies bedeutet, dass der isentrope Prozess ein Sonderfall eines adiabatischen Prozesses ist, bei dem keine Wärme- oder Materieübertragung stattfindet. Es ist ein reversibler adiabatischer Prozess . Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Näherung nur in sehr schnellen Prozessen verwenden können .
Isentropischer Prozess und das erste Gesetz
Für ein geschlossenes System können wir den ersten Hauptsatz der Thermodynamik in Bezug auf die Enthalpie schreiben :
dH = dQ + Vdp
oder
dH = TdS + Vdp
Isentropischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (für ideales Gas )
Isentropischer Prozess des idealen Gases
Der isentrope Prozess (ein Sonderfall des adiabatischen Prozesses) kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV κ = konstant
oder
p 1 V 1 κ = p 2 V 2 κ
wobei κ = c p / c v das Verhältnis der spezifischen Wärme (oder Wärmekapazitäten ) für das Gas ist. Eine für konstanten Druck (c p ) und eine für konstantes Volumen (c v ) . Es ist zu beachten, dass dieses Verhältnis κ = c p / c v ein Faktor bei der Bestimmung der Schallgeschwindigkeit in einem Gas und anderen adiabatischen Prozessen ist.
Isochorischer Prozess
Ein isochorer Prozess ist ein thermodynamischer Prozess, bei dem das Volumen des geschlossenen Systems konstant bleibt (V = const). Es beschreibt das Verhalten von Gas im Behälter, das nicht verformt werden kann. Da das Volumen konstant bleibt, funktioniert der Wärmeübergang in oder aus dem System nicht mit p∆V , sondern ändert nur die innere Energie (die Temperatur) des Systems.
Isochorischer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit . Dann:
dU = dQ – pdV
Beim isochoren Prozess und beim idealen Gas wird die gesamte dem System zugeführte Wärme zur Erhöhung der inneren Energie verwendet.
Isochorischer Prozess (pdV = 0):
dU = dQ (für ideales Gas)
dU = 0 = Q – W → W = Q (für ideales Gas)
Isochorischer Prozess des idealen Gases
Der isochore Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
oder
In einem pV-Diagramm erfolgt der Prozess entlang einer horizontalen Linie mit der Gleichung V = konstant.
Siehe auch: Guy-Lussacs Gesetz
Isobarer Prozess
Ein isobarer Prozess ist ein thermodynamischer Prozess , bei dem der Druck des Systems konstant bleibt (p = const). Die Wärmeübertragung in oder aus dem System funktioniert zwar, verändert aber auch die innere Energie des Systems.
Da sich die innere Energie (dU) und das Systemvolumen (∆V) ändern, verwenden Ingenieure häufig die Enthalpie des Systems, die wie folgt definiert ist:
H = U + pV
Isobarer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit . Bei einem isobaren Prozess und dem idealen Gas wird ein Teil der dem System zugeführten Wärme für die Arbeit verwendet, und ein Teil der zugeführten Wärme erhöht die innere Energie (erhöht die Temperatur). Daher ist es zweckmäßig, die Enthalpie anstelle der inneren Energie zu verwenden.
Isobarer Prozess (Vdp = 0):
dH = dQ → Q = H 2 – H 1
Bei konstanter Entropie , dh im isentropischen Prozess, entspricht die Enthalpieänderung der am oder vom System durchgeführten Flussprozessarbeit .
Isobarer Prozess des idealen Gases
Der isobare Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
oder
In einem pV-Diagramm erfolgt der Prozess entlang einer horizontalen Linie (Isobare genannt) mit der Gleichung p = Konstante.
Siehe auch: Charles ‘Gesetz
Vergleich von tatsächlichen und idealen Dieselzyklen
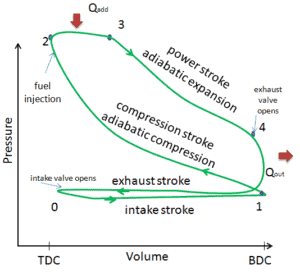 In diesem Artikel wird ein idealer Dieselzyklus gezeigt, bei dem viele Annahmen vom tatsächlichen Dieselzyklus abweichen . Die Hauptunterschiede zwischen dem tatsächlichen und dem idealen Dieselmotor sind in der Abbildung dargestellt. In der Realität tritt der ideale Zyklus nicht auf und mit jedem Prozess sind viele Verluste verbunden. Für einen tatsächlichen Zyklus ähnelt die Form des pV-Diagramms dem Ideal, aber die vom pV-Diagramm eingeschlossene Fläche (Arbeit) ist immer kleiner als der ideale Wert. Der ideale Dieselzyklus basiert auf folgenden Annahmen:
In diesem Artikel wird ein idealer Dieselzyklus gezeigt, bei dem viele Annahmen vom tatsächlichen Dieselzyklus abweichen . Die Hauptunterschiede zwischen dem tatsächlichen und dem idealen Dieselmotor sind in der Abbildung dargestellt. In der Realität tritt der ideale Zyklus nicht auf und mit jedem Prozess sind viele Verluste verbunden. Für einen tatsächlichen Zyklus ähnelt die Form des pV-Diagramms dem Ideal, aber die vom pV-Diagramm eingeschlossene Fläche (Arbeit) ist immer kleiner als der ideale Wert. Der ideale Dieselzyklus basiert auf folgenden Annahmen:
- Geschlossener Zyklus : Der größte Unterschied zwischen den beiden Diagrammen besteht in der Vereinfachung der Einlass- und Auslasshübe im idealen Zyklus. Im Auspuffhub wird die Wärme Q out an die Umgebung abgegeben (bei einem echten Motor verlässt das Gas den Motor und wird durch ein neues Gemisch aus Luft und Kraftstoff ersetzt).
- Isobare Wärmezugabe . Bei echten Motoren ist die Wärmezufuhr niemals isobar.
- Keine Wärmeübertragung
- Kompression – Das Gas wird adiabatisch von Zustand 1 nach Zustand 2 komprimiert. Bei realen Motoren gibt es immer einige Ineffizienzen, die den thermischen Wirkungsgrad verringern.
- Erweiterung. Das Gas expandiert adiabatisch von Zustand 3 zu Zustand 4.
- Vollständige Verbrennung des Gemisches.
- Keine Pumparbeit . Pumparbeit ist der Unterschied zwischen der Arbeit während des Auslasshubs und der Arbeit während des Einlasshubs. In realen Kreisprozessen besteht ein Druckunterschied zwischen Abgas- und Eingangsdruck.
- Kein Abblasverlust . Der Abblasverlust wird durch das frühe Öffnen der Auslassventile verursacht. Dies führt zu einem Verlust der Arbeitsleistung während des Expansionshubs.
- Kein Blow-by-Verlust . Der Blow-by-Verlust wird durch das Austreten von Druckgasen durch Kolbenringe und andere Spalten verursacht.
- Keine Reibungsverluste .
Diese vereinfachenden Annahmen und Verluste führen dazu, dass der geschlossene Bereich (Arbeit) des pV-Diagramms für einen tatsächlichen Motor erheblich kleiner ist als die Größe des Bereichs (Arbeit), der vom pV-Diagramm des idealen Zyklus eingeschlossen ist. Mit anderen Worten, der ideale Motorzyklus überschätzt das Netz und bei gleicher Drehzahl die vom tatsächlichen Motor erzeugte Leistung um etwa 20% (ähnlich wie beim Otto-Motor).
Wärmewirkungsgrad für Dieselkreislauf
Im allgemeinen wird die thermischen Wirkungsgrad , η th , ein Wärmekraftmaschine ist als das Verhältnis der definierten Arbeits es tut, W , an den Wärmeeingang bei der hohen Temperatur, Q H .
Der thermische Wirkungsgrad , η th , stellt den Anteil an Wärme , Q H , die konvertiert wird , zu arbeiten . Da Energie nach dem ersten Hauptsatz der Thermodynamik eingespart wird und Energie nicht vollständig in Arbeit umgewandelt werden kann , muss der Wärmeeintrag Q H gleich der geleisteten Arbeit W plus der Wärme sein, die als Abwärme Q C an die abgegeben werden muss Umgebung. Daher können wir die Formel für den thermischen Wirkungsgrad wie folgt umschreiben:
Die absorbierte Wärme tritt während der Verbrennung des Kraftstoff-Luft-Gemisches auf, wenn der Funke ungefähr bei konstantem Volumen auftritt. Da während eines isochoren Prozesses keine Arbeit von oder am System ausgeführt wird, schreibt der erste Hauptsatz der Thermodynamik ∆U = ∆Q vor. Daher ist die hinzugefügte und abgegebene Wärme gegeben durch:
Q add = mc p (T 3 – T 2 )
Q out = mc v (T 4 – T 1 )
Das Ersetzen der Ausdrücke für die Wärme, die hinzugefügt und im Ausdruck für die thermische Effizienz verworfen wird, ergibt:
Diese Gleichung kann mit dem Kompressionsverhältnis und dem Grenzverhältnis in die Form umgeordnet werden:
wo
- η Diesel ist der maximale thermische Wirkungsgrad eines Dieselzyklus
- α ist das Grenzverhältnis V 3 / V 2 (dh das Volumenverhältnis am Ende und zu Beginn der Verbrennungsphase)
- CR ist das Kompressionsverhältnis
- κ = c p / c v = 1,4
Dies ist eine sehr nützliche Schlussfolgerung, da es wünschenswert ist, ein hohes Verdichtungsverhältnis zu erreichen, um mehr mechanische Energie aus einer gegebenen Masse des Kraftstoffs zu extrahieren. Wie wir im vorherigen Abschnitt festgestellt haben, ist der thermische Wirkungsgrad des Otto-Zyklus nach Luftstandard auch eine Funktion des Kompressionsverhältnisses und von κ.
Wenn wir diese mit Formeln vergleichen, kann man sehen, dass für ein gegebenes Kompressionsverhältnis (CR) der Otto-Zyklus effizienter ist als der Diesel-Zyklus. Dieselmotoren sind jedoch normalerweise effizienter, da sie mit höheren Verdichtungsverhältnissen arbeiten können.
Bei gewöhnlichen Otto-Motoren hat das Verdichtungsverhältnis seine Grenzen. Das Verdichtungsverhältnis in einem benzinbetriebenen Motor ist normalerweise nicht viel höher als 10: 1. Höhere Verdichtungsverhältnisse führen dazu, dass Benzinmotoren durch Selbstentzündung einem unverbrannten Gemisch ausgesetzt werden, wenn Kraftstoff mit niedrigerer Oktanzahl verwendet wird. Bei Dieselmotoren besteht nur ein minimales Risiko einer Selbstentzündung des Kraftstoffs, da Dieselmotoren Selbstzündungsmotoren sind und sich zu Beginn des Kompressionshubs kein Kraftstoff im Zylinder befindet.
Dieselzyklus – Problem mit der Lösung

Nehmen wir den Dieselzyklus an, der einer der häufigsten thermodynamischen Kreisprozessen ist, die in Automotoren zu finden sind . Einer der Schlüsselparameter solcher Motoren ist die Volumenänderung zwischen dem oberen Totpunkt (OT) und dem unteren Totpunkt (BDC). Das Verhältnis dieser Volumina ( V 1 / V 2 ) ist als Kompressionsverhältnis bekannt . Auch das Abschaltverhältnis V 3 / V 2 , das das Volumenverhältnis am Ende und zu Beginn der Verbrennungsphase ist.
In diesem Beispiel sei der Dieselzyklus mit einem Verdichtungsverhältnis von CR = 20: 1 und einem Abschaltverhältnis von α = 2 angenommen. Die Luft hat 100 kPa = 1 bar, 20 ° C (293 K) und das Volumen der Kammer beträgt 500 cm³ vor dem Kompressionshub.
- Spezifische Wärmekapazität bei konstantem Luftdruck bei Atmosphärendruck und Raumtemperatur: c p = 1,01 kJ / kgK.
- Spezifische Wärmekapazität bei konstantem Luftvolumen bei Atmosphärendruck und Raumtemperatur: c v = 0,718 kJ / kgK.
- κ = c p / c v = 1,4
Berechnung:
- die Masse der Ansaugluft
- die Temperatur T 2
- der Druck p 2
- die Temperatur T 3
- die Wärmemenge, die durch Verbrennen des Kraftstoff-Luft-Gemisches zugeführt wird
- der thermische Wirkungsgrad dieses Zyklus
- der Europaabgeordnete
Lösung:
1)
Zu Beginn der Berechnungen müssen wir die Gasmenge in der Flasche vor dem Kompressionshub bestimmen. Mit dem idealen Gasgesetz können wir die Masse finden:
pV = mR- spezifisches T.
wo:
- p ist der absolute Druck des Gases
- m ist die Masse der Substanz
- T ist die absolute Temperatur
- V ist die Lautstärke
- R spezifisch ist die spezifische Gaskonstante, die gleich der universellen Gaskonstante geteilt durch die Molmasse (M) des Gases oder Gemisches ist. Für trockene Luft R spezifisch = 287,1 J.kg -1 .K -1 .
Deshalb
m = p 1 V 1 / R spezifisch T 1 = (100000 × 500 × 10 –6 ) / (287,1 × 293) = 5,95 × 10 –4 kg
2)
In diesem Problem sind alle Volumes bekannt:
- V 1 = V 4 = V max = 500 × 10 –6 m 3 (0,5 l)
- V 2 = V min = V max / CR = 25 × 10 –6 m 3
Beachten Sie, dass (V max – V min ) x Anzahl der Zylinder = Gesamtmotorhubraum
Da der Prozess adiabatisch ist, können wir die folgende p, V, T-Beziehung für adiabatische Prozesse verwenden:
somit
T 2 = T 1 . CR & kgr; – 1 = 293. 20 0,4 = 971 K.
3)
Wieder können wir das ideale Gasgesetz verwenden, um den Druck am Ende des Kompressionshubs zu ermitteln als:
p 2 = mR- spezifisches T 2 / V 2 = 5,95 × 10 –4 × 287,1 × 971/25 × 10 –6 = 6635000 Pa = 66,35 bar
4)
Da Prozess 2 → 3 bei konstantem Druck abläuft, ergibt sich die ideale Gaszustandsgleichung
T 3 = (V 3 / V 2 ) × T 2 = 1942 K.
Um die Wärmemenge zu berechnen, die durch Verbrennen des Kraftstoff-Luft-Gemisches Q add hinzugefügt wird , müssen wir den ersten Hauptsatz der Thermodynamik für isobare Prozesse verwenden, der besagt:
Q add = mc p (T 3 – T 2 ) = 5,95 × 10 –4 × 10 10 × 971 = 583,5 J.
5)
Wärmewirkungsgrad für diesen Dieselkreislauf:
Wie im vorherigen Abschnitt abgeleitet, ist der thermische Wirkungsgrad des Dieselzyklus eine Funktion des Verdichtungsverhältnisses, des Abschaltverhältnisses und von κ:
- η Diesel ist der maximale thermische Wirkungsgrad eines Dieselzyklus
- α ist das Grenzverhältnis V 3 / V 2 (dh das Volumenverhältnis am Ende und am Beginn der Verbrennungsphase)
- CR ist das Kompressionsverhältnis
- κ = c p / c v = 1,4
Für dieses Beispiel:
η Diesel = 0,6467 = 64,7%
6)
Der Europaabgeordnete wurde definiert als:
In dieser Gleichung ist das Verschiebungsvolumen gleich V max – V min . Das Netzwerk für einen Zyklus kann anhand der zugeführten Wärme und des thermischen Wirkungsgrads berechnet werden:
W net = Q add . η Otto = 583,5 × 0,6467 = 377,3 J.
MEP = 377,3 / ( 500 × 10 –6 – 25 × 10 –6 ) = 794,3 kPa = 7,943 bar
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.