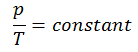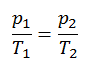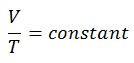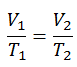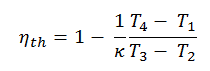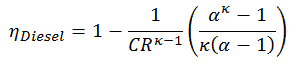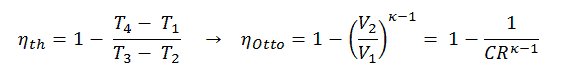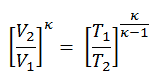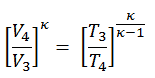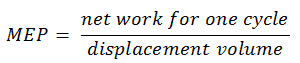Cycle diesel – moteur diesel
Dans les années 1890, un inventeur allemand, Rudolf Diesel, a breveté son invention d’un moteur à combustion interne efficace et à combustion lente. Le cycle initial proposé par Rudolf Diesel était un cycle à température constante. Dans les années qui suivirent, Diesel réalisa que son cycle initial ne fonctionnerait pas et il adopta le cycle de pression constante, appelé cycle Diesel .
Le cycle diesel est l’un des cycles thermodynamiques les plus courants que l’on puisse trouver dans les moteurs d’automobiles et décrit le fonctionnement d’un moteur à piston à allumage par compression typique. Le moteur diesel fonctionne de manière similaire au moteur à essence. La différence la plus importante est que:
- Il n’y a pas d’essence dans le cylindre au début de la course de compression; par conséquent, l’autoallumage ne se produit pas dans les moteurs diesel.
- Le moteur diesel utilise un allumage par compression au lieu d’un allumage par étincelle.
- En raison de la température élevée développée lors de la compression adiabatique, le carburant s’enflamme spontanément lors de son injection. Par conséquent, aucune bougie n’est nécessaire.
- Avant le début de la course de puissance, les injecteurs commencent à injecter du carburant directement dans la chambre de combustion. Par conséquent, la première partie de la course de puissance se produit approximativement à la pression constante.
- Des taux de compression plus élevés peuvent être atteints dans les moteurs diesel , par rapport aux moteurs Otto
Cycle Diesel – Processus
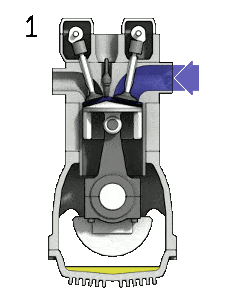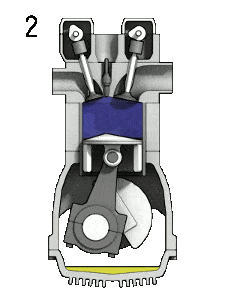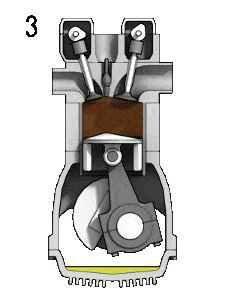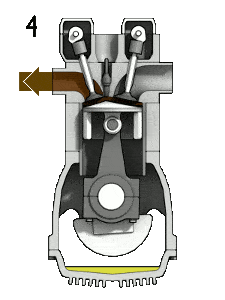
Dans un cycle Diesel idéal, le système exécutant le cycle subit une série de quatre processus: deux processus isentropiques (adiabatiques réversibles) alternés avec un processus isochore et un processus isobare.
-
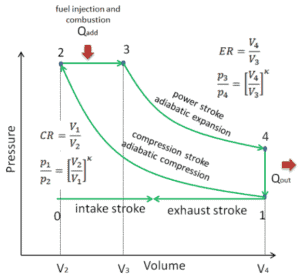
Diagramme pV d’un cycle Diesel idéal Compression isentropique (course de compression) – L’air est comprimé de manière adiabatique de l’état 1 à l’état 2, lorsque le piston se déplace du point mort bas au point mort haut. Les environs agissent sur le gaz, augmentant son énergie interne (température) et le compressant. En revanche, l’entropie reste inchangée. L’évolution des volumes et de son rapport ( V 1 / V 2 ) est connue sous le nom de taux de compression.
- Expansion isobare (phase d’allumage) – Dans cette phase (entre l’état 2 et l’état 3) il y a un transfert de chaleur à pression constante (modèle idéalisé) vers l’air à partir d’une source externe (combustion de carburant injecté) tandis que le piston se déplace vers le V 3 . Pendant le processus à pression constante, l’énergie pénètre dans le système sous forme de chaleur Q ajoutée , et une partie du travail se fait en déplaçant le piston.
- Expansion isentropique (course de puissance) – Le gaz se détend adiabatiquement de l’état 3 à l’état 4, lorsque le piston se déplace de V 3 au point mort bas. Le gaz travaille sur l’environnement (piston) et perd une quantité d’énergie interne égale au travail qui quitte le système. Encore une fois, l’entropie reste inchangée. Le rapport volumique ( V 4 / V 3 ) est connu comme le rapport d’expansion isentropique.
- Décompression isochore (course d’échappement) – Dans cette phase, le cycle se termine par un processus à volume constant dans lequel la chaleur est rejetée de l’air tandis que le piston est au point mort bas. La pression du gaz de travail chute instantanément du point 4 au point 1. La soupape d’échappement s’ouvre au point 4. La course d’échappement survient directement après cette décompression. Lorsque le piston se déplace du point mort bas (point 1) au point mort haut (point 0) avec la soupape d’échappement ouverte, le mélange gazeux est évacué vers l’atmosphère et le processus recommence.
Pendant le cycle Diesel, un travail est effectué sur le gaz par le piston entre les états 1 et 2 ( i compression sentropique ). Le travail se fait par le gaz sur le piston entre les étapes 2 et 3 ( i addition de chaleur sobarique ) et entre les étapes 2 et 3 ( i expansion sentropique ). La différence entre le travail effectué par le gaz et le travail effectué sur le gaz est le travail net produit par le cycle et il correspond à la zone délimitée par la courbe du cycle. Le travail produit par le cycle multiplie la vitesse du cycle (cycles par seconde) par la puissance produite par le moteur Diesel.
Processus isentropique
Un processus isentropique est un processus thermodynamique , dans lequel l’ entropie du fluide ou du gaz reste constante. Cela signifie que le processus isentropique est un cas particulier d’un processus adiabatique dans lequel il n’y a pas de transfert de chaleur ou de matière. Il s’agit d’un processus adiabatique réversible . L’hypothèse d’absence de transfert de chaleur est très importante, car nous ne pouvons utiliser l’approximation adiabatique que dans des processus très rapides .
Processus isentropique et première loi
Pour un système fermé, on peut écrire la première loi de la thermodynamique en termes d’enthalpie :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processus isentropique (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (pour le gaz parfait )
Processus isentropique du gaz parfait
Le processus isentropique (un cas particulier du processus adiabatique) peut être exprimé avec la loi du gaz parfait comme:
pV κ = constant
ou
p 1 V 1 κ = p 2 V 2 κ
dans laquelle κ = c p / c v est le rapport des chaleurs spécifiques (ou capacités calorifiques ) pour le gaz. Un pour une pression constante (c p ) et un pour un volume constant (c v ) . Notez que ce rapport κ = c p / c v est un facteur déterminant la vitesse du son dans un gaz et d’autres processus adiabatiques.
Processus isochorique
Un processus isochore est un processus thermodynamique, dans lequel le volume du système fermé reste constant (V = const). Il décrit le comportement du gaz à l’intérieur du conteneur, qui ne peut pas être déformé. Étant donné que le volume reste constant, le transfert de chaleur dans ou hors du système ne fonctionne pas avec le p∆V , mais modifie uniquement l’ énergie interne (la température) du système.
Processus isochorique et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites . Alors:
dU = dQ – pdV
Dans le processus isochore et le gaz parfait , toute la chaleur ajoutée au système sera utilisée pour augmenter l’énergie interne.
Processus isochorique (pdV = 0):
dU = dQ (pour le gaz parfait)
dU = 0 = Q – W → W = Q (pour le gaz parfait)
Processus isochorique du gaz parfait
Le processus isochore peut s’exprimer avec la loi du gaz parfait comme:
ou
Sur un diagramme pV , le processus se produit le long d’une ligne horizontale qui a l’équation V = constante.
Voir aussi: Loi de Guy-Lussac
Processus isobare
Un processus isobare est un processus thermodynamique , dans lequel la pression du système reste constante (p = const). Le transfert de chaleur dans ou hors du système fonctionne, mais modifie également l’énergie interne du système.
Puisqu’il y a des changements d’ énergie interne (dU) et des changements de volume du système (∆V), les ingénieurs utilisent souvent l’ enthalpie du système, qui est définie comme:
H = U + pV
Processus isobare et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites . Dans un procédé isobare et le gaz parfait, une partie de la chaleur ajoutée au système sera utilisée pour faire le travail et une partie de la chaleur ajoutée augmentera l’ énergie interne (augmentera la température). Par conséquent, il est commode d’utiliser l’ enthalpie au lieu de l’énergie interne.
Processus isobare (Vdp = 0):
dH = dQ → Q = H 2 – H 1
À entropie constante , c’est-à-dire dans un processus isentropique, le changement d’enthalpie est égal au travail de processus d’écoulement effectué sur ou par le système.
Processus isobare du gaz parfait
Le processus isobare peut s’exprimer avec la loi du gaz parfait comme:
ou
Sur un diagramme pV , le processus se produit le long d’une ligne horizontale (appelée isobare) qui a l’équation p = constante.
Voir aussi: Charles’s Law
Comparaison des cycles diesel réels et idéaux
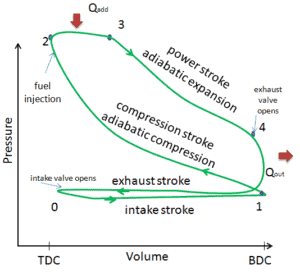 Dans cet article, il est montré un cycle Diesel idéal dans lequel il y a beaucoup d’hypothèses différentes du cycle Diesel réel . Les principales différences entre le moteur diesel réel et le moteur diesel idéal apparaissent sur la figure. En réalité, le cycle idéal ne se produit pas et il y a de nombreuses pertes associées à chaque processus. Pour un cycle réel, la forme du diagramme pV est similaire à l’idéal, mais la zone (travail) entourée par le diagramme pV est toujours inférieure à la valeur idéale. Le cycle Diesel idéal est basé sur les hypothèses suivantes:
Dans cet article, il est montré un cycle Diesel idéal dans lequel il y a beaucoup d’hypothèses différentes du cycle Diesel réel . Les principales différences entre le moteur diesel réel et le moteur diesel idéal apparaissent sur la figure. En réalité, le cycle idéal ne se produit pas et il y a de nombreuses pertes associées à chaque processus. Pour un cycle réel, la forme du diagramme pV est similaire à l’idéal, mais la zone (travail) entourée par le diagramme pV est toujours inférieure à la valeur idéale. Le cycle Diesel idéal est basé sur les hypothèses suivantes:
- Cycle fermé : La plus grande différence entre les deux diagrammes est la simplification des courses d’admission et d’échappement dans le cycle idéal. Lors de la course d’échappement, la chaleur Q out est éjectée dans l’environnement (dans un vrai moteur, le gaz quitte le moteur et est remplacé par un nouveau mélange d’air et de carburant).
- Ajout de chaleur isobare . Dans les moteurs réels, l’apport de chaleur n’est jamais isobare.
- Pas de transfert de chaleur
- Compression – Le gaz est comprimé adiabatiquement de l’état 1 à l’état 2. Dans les moteurs réels, il y a toujours des inefficacités qui réduisent l’efficacité thermique.
- Expansion. Le gaz se détend adiabatiquement de l’état 3 à l’état 4.
- Combustion complète du mélange.
- Aucun travail de pompage . Le travail de pompage est la différence entre le travail effectué pendant la course d’échappement et le travail effectué pendant la course d’admission. Dans les cycles réels, il existe une différence de pression entre les pressions d’échappement et d’entrée.
- Aucune perte de purge . La perte de purge est causée par l’ouverture précoce des soupapes d’échappement. Il en résulte une perte de rendement de travail pendant la course d’expansion.
- Pas de perte par coup . La perte par soufflage est causée par la fuite de gaz comprimés à travers les segments de piston et autres crevasses.
- Pas de pertes par friction .
Ces hypothèses et pertes simplificatrices conduisent au fait que la zone fermée (travail) du diagramme pV pour un moteur réel est significativement plus petite que la taille de la zone (travail) incluse par le diagramme pV du cycle idéal. En d’autres termes, le cycle moteur idéal surestimera le travail net et, si les moteurs tournent à la même vitesse, une plus grande puissance produite par le moteur réel d’environ 20% (de la même manière que dans le cas du moteur Otto).
Efficacité thermique pour le cycle diesel
En général , le rendement thermique , η e , d’un moteur thermique est définie comme étant le rapport entre le travail qu’elle fait, W , à la chaleur d’ entrée à la température élevée, Q H .
L’ efficacité thermique , η th , représente la fraction de chaleur , Q H , qui est convertie en travail . Puisque l’énergie est conservée selon la première loi de la thermodynamique et que l’énergie ne peut pas être convertie pour fonctionner complètement, l’apport de chaleur, Q H , doit être égal au travail effectué, W, plus la chaleur qui doit être dissipée sous forme de chaleur résiduelle Q C dans le environnement. Par conséquent, nous pouvons réécrire la formule de l’efficacité thermique comme suit:
La chaleur absorbée se produit pendant la combustion du mélange carburant-air, lorsque l’étincelle se produit, à peu près à volume constant. Puisqu’au cours d’un processus isochore, aucun travail n’est effectué par ou sur le système, la première loi de la thermodynamique dicte ∆U = ∆Q. Par conséquent, la chaleur ajoutée et rejetée est donnée par:
Q add = mc p (T 3 – T 2 )
Q out = mc v (T 4 – T 1 )
En substituant ces expressions à la chaleur ajoutée et rejetée dans l’expression pour l’efficacité thermique, on obtient:
Cette équation peut être réorganisée à la forme avec le taux de compression et le taux de coupure:
où
- η Diesel est l’efficacité thermique maximale d’un cycle Diesel
- α est le rapport de coupure V 3 / V 2 (c’est-à-dire le rapport des volumes à la fin et au début de la phase de combustion)
- CR est le taux de compression
- κ = c p / c v = 1,4
C’est une conclusion très utile, car il est souhaitable d’atteindre un taux de compression élevé pour extraire plus d’énergie mécanique d’une masse donnée de carburant. Comme nous l’avons conclu dans la section précédente, l’efficacité thermique du cycle Otto standard de l’air est également fonction du taux de compression et de κ.
Lorsque nous les comparons à des formules, nous pouvons voir que pour un taux de compression (CR) donné, le cycle Otto sera plus efficace que le cycle Diesel. Mais les moteurs diesel sont généralement plus efficaces car ils peuvent fonctionner à des taux de compression plus élevés.
Dans les moteurs Otto ordinaires, le taux de compression a ses limites. Le taux de compression dans un moteur à essence ne sera généralement pas beaucoup plus élevé que 10: 1. Des taux de compression plus élevés soumettront les moteurs à essence aux cognements du moteur, causés par l’auto-inflammation, en un mélange non brûlé, si du carburant à indice d’octane inférieur est utilisé. Dans les moteurs diesel, le risque d’auto-inflammation du carburant est minime, car les moteurs diesel sont des moteurs à allumage par compression et il n’y a pas de carburant dans le cylindre au début de la course de compression.
Cycle Diesel – Problème avec la solution

Supposons le cycle Diesel, qui est l’un des cycles thermodynamiques les plus courants que l’on puisse trouver dans les moteurs d’automobiles . L’un des paramètres clés de ces moteurs est le changement de volume entre le point mort haut (TDC) et le point mort bas (BDC). Le rapport de ces volumes ( V 1 / V 2 ) est appelé taux de compression . Également le rapport de coupure V 3 / V 2 , qui est le rapport des volumes à la fin et au début de la phase de combustion.
Dans cet exemple, supposons le cycle Diesel avec un taux de compression de CR = 20: 1 et un taux de coupure α = 2. L’air est à 100 kPa = 1 bar, 20 ° C (293 K) et le volume de la chambre est de 500 cm³ avant la course de compression.
- Capacité thermique spécifique à pression d’air constante à pression atmosphérique et température ambiante: c p = 1,01 kJ / kgK.
- Capacité calorifique spécifique à volume d’air constant à pression atmosphérique et température ambiante: c v = 0,718 kJ / kgK.
- κ = c p / c v = 1,4
Calculer:
- la masse d’air d’admission
- la température T 2
- la pression p 2
- la température T 3
- la quantité de chaleur ajoutée par la combustion du mélange air-carburant
- l’efficacité thermique de ce cycle
- le député européen
Solution:
1)
Au début des calculs, nous devons déterminer la quantité de gaz dans le cylindre avant la course de compression. En utilisant la loi du gaz parfait, nous pouvons trouver la masse:
pV = mR spécifique T
où:
- p est la pression absolue du gaz
- m est la masse de substance
- T est la température absolue
- V est le volume
- R spécifique est la constante de gaz spécifique, égale à la constante de gaz universelle divisée par la masse molaire (M) du gaz ou du mélange. Pour l’air sec R spécifique = 287,1 J.kg -1 .K -1 .
Donc
m = p 1 V 1 / R spécifique T 1 = (100000 × 500 × 10 -6 ) / (287,1 × 293) = 5,95 × 10 -4 kg
2)
Dans ce problème, tous les volumes sont connus:
- V 1 = V 4 = V max = 500 × 10 -6 m 3 (0,5 l)
- V 2 = V min = V max / CR = 25 × 10 -6 m 3
Notez que (V max – V min ) x nombre de cylindres = cylindrée totale du moteur
Puisque le processus est adiabatique, nous pouvons utiliser la relation p, V, T suivante pour les processus adiabatiques:
Donc
T 2 = T 1 . CR κ – 1 = 293. 20 0,4 = 971 K
3)
Encore une fois, nous pouvons utiliser la loi du gaz parfait pour trouver la pression à la fin de la course de compression comme:
p 2 = mR spécifique T 2 / V 2 = 5,95 × 10 -4 x 287,1 x 971/25 × 10 -6 = 6635000 Pa = 66,35 bar
4)
Comme le processus 2 → 3 se produit à pression constante, l’équation d’état du gaz parfait donne
T 3 = (V 3 / V 2 ) x T 2 = 1942 K
Pour calculer la quantité de chaleur ajoutée par la combustion du mélange carburant-air, ajoutons Q , nous devons utiliser le première principe de la thermodynamique pour le processus isobare, qui stipule:
Q add = mc p (T 3 – T 2 ) = 5,95 × 10 -4 x 1010 x 971 = 583,5 J
5)
Efficacité thermique pour ce cycle Diesel:
Comme il a été dérivé dans la section précédente, l’efficacité thermique du cycle Diesel est fonction du taux de compression, du taux de coupure et de κ:
- η Diesel est l’efficacité thermique maximale d’un cycle Diesel
- α est le rapport de coupure V 3 / V 2 (c’est-à-dire le rapport des volumes à la fin et au début de la phase de combustion)
- CR est le taux de compression
- κ = c p / c v = 1,4
Pour cet exemple:
η Diesel = 0,6467 = 64,7%
6)
Le député européen a été défini comme:
Si cette équation, le volume de déplacement est égal à V max – V min . Le travail net pour un cycle peut être calculé en utilisant la chaleur ajoutée et l’efficacité thermique:
W net = Q add . η Otto = 583,5 x 0,6467 = 377,3 J
MEP = 377,3 / ( 500 × 10 -6 – 25 × 10 -6 ) = 794,3 kPa = 7,943 bar
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci